| Artigo de Revisão, Biomed Biopharm Res., 2023; 20(2):118-142 doi: 10.19277/bbr.20.2.321; Bilingue PDF [+]; html em inglês [EN] |
Produtos biofarmacêuticos: Uma análise do seu desenvolvimento e contribuição para os cuidados de saúde
Kai Bin Liew 1 ![]() ✉️ , Siew-Keah Lee 2
✉️ , Siew-Keah Lee 2 ![]() , Long Chiau Ming 3
, Long Chiau Ming 3 ![]() , A.B.M. Helal Uddin 4
, A.B.M. Helal Uddin 4 ![]() , Zaidul Islam Sarker 4
, Zaidul Islam Sarker 4 ![]() , Yik-Ling Chew 5
, Yik-Ling Chew 5 ![]() , & Phei Er Kee1
, & Phei Er Kee1 ![]()
1 - Faculty of Pharmacy, University of Cyberjaya, Persiaran Bestari, 63000 Cyberjaya, Selangor, Malaysia
2 - M. Kandiah Faculty of Medicine and Health Sciences, Universiti Tunku Abdul Rahman, Jalan Sungai Long, Bandar Sungai Long, 43000, Kajang, Selangor, Malaysia
3 -School of Medical and Life Sciences, Sunway University, Sunway City, 47500 Malaysia
4 - Faculty of Pharmacy, International Islamic University Malaysia, Bandar Indera Mahkota, Kuantan, Pahang, Malaysia
5 - Faculty of Pharmaceutical Sciences, UCSI University, Jalan Menara Gading, UCSI Heights, 56000 Cheras, Kuala Lumpur, Malaysia
Resumo
Os produtos biofarmacêuticos têm um papel crucial na prevenção, no tratamento e no diagnóstico de uma gama diversificada de doenças em várias disciplinas médicas. O mercado dos produtos biofarmacêuticos registou um crescimento significativo, impulsionado por uma enorme procura, acreditando-se que o seu potencial de mercado dinâmico ultrapassa o dos seus homólogos convencionais. Esta análise fornece informações sobre o processo de fabrico de produtos biofarmacêuticos, abrangendo o processamento a montante e a jusante. São explorados vários tipos de produtos biofarmacêuticos, tais como anticorpos monoclonais, enzimas, vacinas, células estaminais, hormonas de crescimento humano, citocinas, ácidos nucleicos e hidratos de carbono, juntamente com as respectivas aplicações clínicas. A análise também aborda os desafios encontrados no desenvolvimento, formulação e utilização destes produtos biofarmacêuticos. Essencialmente, esta análise contribui com conhecimentos valiosos para a compreensão do vasto domínio dos produtos biofarmacêuticos.
Palavras-chave: biofarmacêuticos, fabrico, recombinante, terapêutica, clínica
Como Citar: Liew, K. B., et al. (2023) Biopharmaceuticals: A review of their development and contribution to healthcare. Biomedical and Biopharmaceutical Research, 20(2),118-142.
Correspondência autor:
Recebido: 24/08/2023; Aceite: 14/12/2023
Introdução
O aumento global da população, associado a uma maior esperança de vida e a uma prevalência crescente de doenças cronicas, com destaque para as doenças auto-imunes, gerou uma procura substancial no mercado de medicamentos mais seguros e eficazes (1). Desde a aprovação do primeiro biofármaco, para uso terapêutico - a insulina humana recombinante de Escherichia coli, em 1982 pela Food and Drug Administration (FDA), a utilização de biofármacos tem vindo a crescer de forma constante (2). O mercado biofarmacêutico global, avaliado em 237,2 mil milhões de dólares em 2018, deverá atingir 389,0 mil milhões de dólares em 2024, com uma taxa de crescimento anual composta (CAGR) de 8,59% de 2019 a 2024 (2). Os produtos biofarmacêuticos desempenham um papel crucial na melhoria dos cuidados de saúde, no aumento da longevidade produtiva saudável e na redução da prevalência de doenças graves. Estudos indicam que a inovação biofarmacêutica contribuiu para cerca de 35% do aumento da esperança de vida entre 1990 e 2015, levando a uma melhoria da esperança média de vida dos indivíduos de 46,5 anos para 65,0 anos (3).
Os biofármacos são produtos farmacêuticos produzidos através de processos biotecnológicos, empregando técnicas como o ADN recombinante ou o hibridoma. As fontes biológicas e os organismos vivos, tais como bactérias, vírus, leveduras, células animais e vegetais, são normalmente utilizados para a produção de produtos biofarmacêuticos (4, 5). Os produtos biofarmacêuticos apresentam um peso molecular mais elevado e uma estrutura mais complexa, tipicamente 100-1000 vezes maior do que os medicamentos sintéticos, devido à formação de cadeias poliméricas (5). Estes produtos incluem polissacáridos, proteínas, ácidos nucleicos, tecidos e células vivas, encontrando aplicações extensivas em vários domínios médicos.
Os produtos biofarmacêuticos são reconhecidos pela sua eficácia no diagnóstico, prevenção, tratamento e cura de um vasto espetro de doenças crónicas e potencialmente fatais, incluindo perturbações metabólicas e cancro (6). A sua especificidade em relação a determinados alvos permite que os biofármacos reconheçam e visem locais e doenças específicos, minimizando os efeitos secundários indesejáveis. Além disso, os biofármacos podem servir como tratamento alternativo para os doentes com fraca resposta aos tratamentos convencionais, com elevada biodisponibilidade, semi-vida aumentada e menor imunogenicidade (6). Devido à complexidade e instabilidade dos produtos, bem como à baixa absorção intestinal, a administração oral é geralmente inadequada para os biofármacos. Dada a ocorrência de uma redução substancial da permeabilidade através de barreiras biológicas como a pele, as membranas mucosas e as membranas celulares, a injeção subcutânea surge como o método de administração preferido (7, 8).
Esta análise analisa o processo de fabrico de produtos biofarmacêuticos e explora vários tipos de produtos biofarmacêuticos, incluindo anticorpos monoclonais (mAbs), vacinas, enzimas, hormonas, produtos de terapia celular e citocinas, juntamente com as suas aplicações clínicas. Os desafios encontrados no desenvolvimento e aplicação de produtos biofarmacêuticos também são discutidos, fornecendo uma visão abrangente deste domínio dinâmico.
Processo de fabrico
O fabrico de produtos biofarmacêuticos envolve duas fases complexas, nomeadamente o processamento a montante e o processamento a jusante. A Figura 1 ilustra o fluxograma do processo de fabrico de produtos biofarmacêuticos. O processamento a montante está relacionado com o crescimento dos microrgaanismos e a transformação de substratos nos produtos biofarmacêuticos desejados (9). Várias actividades, incluindo a seleção de linhas celulares, a composição do meio de cultura, a otimização do processo e parâmetros de crescimento, são realizadas para obter o crescimento celular e uma produção ideais (10). O processo de fermentação ocorre em condições controladas num sistema de biorreactores de grande escala, onde medidas como a esterilização de materiais e equipamento, a regulação do pH, o controlo da temperatura e o fornecimento de oxigénio são cruciais para minimizar o risco de contaminação por outros microrganismos (11).
| Figura 1. Fluxograma do processo de fabrico de produtos biofarmacêuticos. |
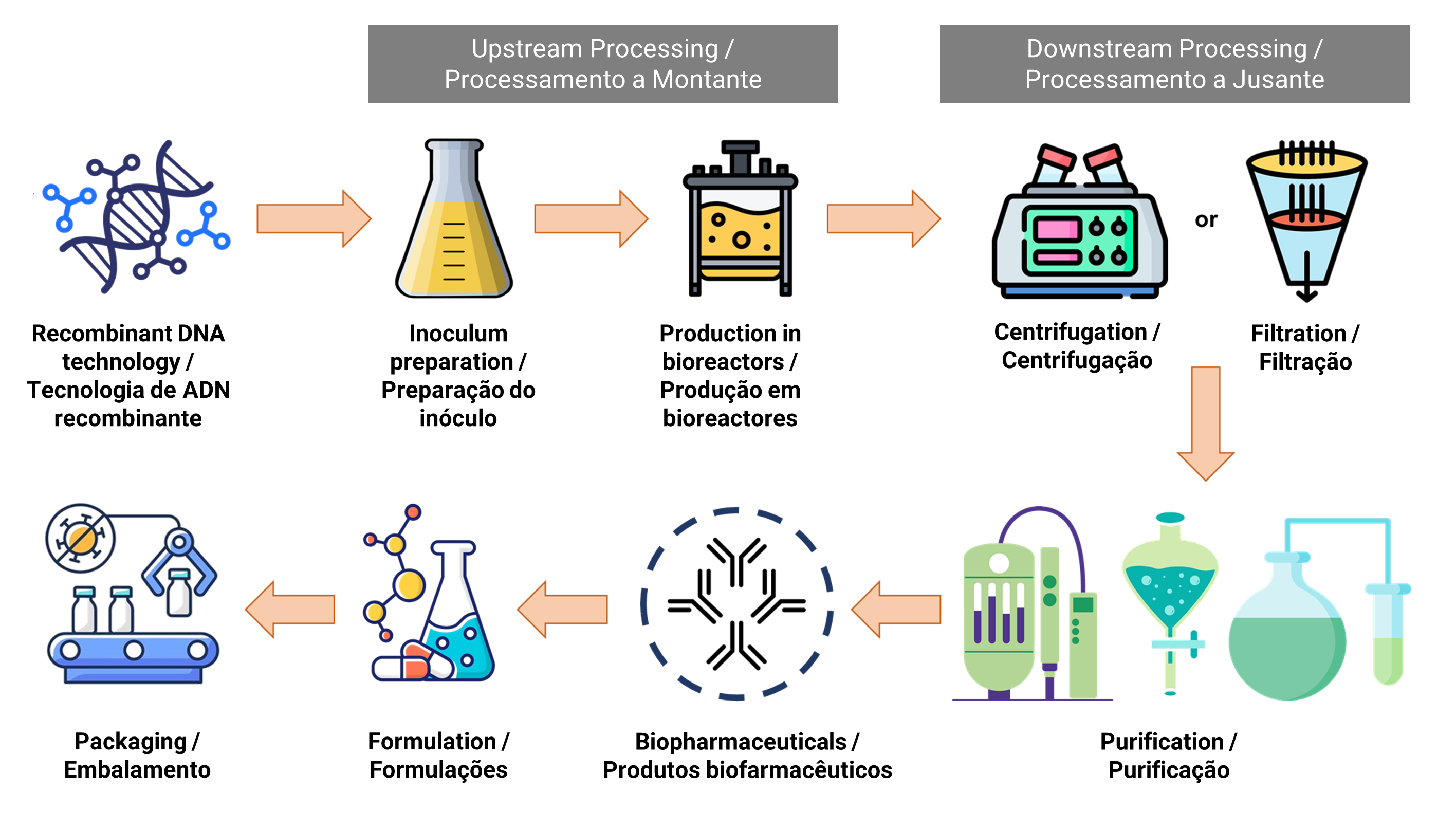 |
Os biofármacos são geralmente produzidos através de células vivas geneticamente modificadas, envolvendo a introdução de sequências de ADN na célula hospedeira do organismo vivo. A E. coli destaca-se como um microrganismo eficiente para a produção de proteínas recombinantes. Ao substituir códons raramente encontrados em genes altamente expressos de E. coli por códons principais mais favoráveis, o nível de expressão das proteínas heterólogas pode ser melhorado (12). Além disso, as proteínas terapêuticas complexas e de grandes dimensões podem ser segregadas no periplasma de E. coli, proporcionando um ambiente oxidante propício à formação de ligações dissulfureto que facilitam a dobragem adequada das proteínas recombinantes (13). As proteínas heterólogas acumulam-se frequentemente em E. coli sob a forma de corpos de inclusão, que são o agregados insolúveis mal dobrados. Por exemplo, a insulina humana recombinante tem sido expressa principalmente por E. coli, demonstrando o seu potencial para o tratamento da diabetes mellitus tipo I e II (14).
Além disso, a levedura é normalmente utilizada para a expressão de proteínas heterólogas que requerem modificações pós-translacionais para a sua atividade biológica, incluindo acetilação, acilação, fosforilação, glicosilação O-ligada e glicosilação N-ligada (14). O sistema de expressão da levedura produz proteínas recombinantes solúveis que estão corretamente dobradas e funcionalmente activas. Além disso, as leveduras podem segregar as proteínas para o meio extracelular, facilitando assim o processo de purificação subsequente (15). Foi efectuada uma investigação aprofundada em Saccharomyces cerevisiae e Pichia pastoris, ambas capazes de realizar padrões de N-glicosilação semelhantes aos humanos, incluindo a adição terminal de ácido siálico à glicoproteína. As leveduras são produtores proeminentes de precursores da insulina, albumina sérica humana, glucagon, antigénios da hepatite e partículas semelhantes a vacinas para várias aplicações terapêuticas (16, 17).
As culturas de células de mamíferos desempenham um papel importante na produção de produtos biofarmacêuticos, sendo as linhas de células de ovário de hamster chinês (CHO), as linhas de células de rim de hamster bebé (BHK21) e as células de mieloma murino as mais utilizadas (18, 19). Entre estas, as linhas celulares CHO são particularmente populares devido à sua capacidade de exprimir eficazmente proteínas terapêuticas complexas com glicopadrões semelhantes aos humanos, atingindo uma elevada densidade celular e rendimentos suficientes. As linhas celulares CHO são capazes de crescer em meio quimicamente definido sem soro, o que as torna adequadas para biorreactores de grande volume e simplifica os processos a jusante. Os avanços nas ferramentas genéticas, como as nucleases de dedo de zinco (ZFNs), as nucleases efectoras do tipo ativador da transcrição (TALENs) e o sistema associado à repetição palindrómica curta regularmente espaçada (CRISPR) ofereceram oportunidades para a engenharia de linhas celulares CHO, melhorando a produção de proteínas e a qualidade dos produtos (20). Uma variedade de produtos biofarmacêuticos, incluindo hormonas de crescimento humano, citocinas, mAbs e factores de coagulação, foram produzidos com êxito utilizando células CHO (19).
Além disso, a tecnologia de hibridoma constitui outra opção para a produção de mAbs, oferecendo comodidade, rentabilidade e elevados rendimentos de produção (21). As células de hibridoma são geradas através da fusão de um linfócito B ativado com uma célula de mieloma imortal. Cada célula de hibridoma expressa consistentemente uma grande quantidade de um mAbs altamente específico e os clones de hibridoma seleccionados podem ser criopreservados para a produção contínua de mAbs durante um período prolongado. O processo de geração de hibridomas aproveita a capacidade natural do animal hospedeiro para produzir mAbs funcionais, altamente específicos e de elevada afinidade (22). Foram utilizadas diferentes espécies animais para o desenvolvimento de mAbs, incluindo ratos, coelhos, porquinhos-da-índia, galinhas, vacas, cabras, hamsters e ovelhas. A seleção das espécies animais depende de factores como a presença de uma proteína homóloga na espécie imunizada, a quantidade de proteína ou antigénio disponível para imunização, a disponibilidade de um parceiro de fusão adequado, a duração necessária para obter uma resposta de anticorpos e o objetivo pretendido para o qual estes mAbs são necessários (22, 23). Os hibridomas são geralmente classificados em homo-hibridomas e hetero-hibridomas, em que as células B secretoras de IgG e os parceiros de fusão são da mesma espécie e de espécies diferentes, respetivamente (24).
Após os processos a montante na produção de produtos biofarmacêuticos, o processamento a jusante torna-se essencial para purificar os produtos biológicos desejados a partir do caldo de cultura celular. Este processo a jusante compreende várias fases, incluindo a recuperação primária, a purificação e o polimento, com o objetivo de eliminar as impurezas relacionadas com o processo e com o produto, a fim de garantir a segurança dos produtos biofarmacêuticos (25). Na recuperação primária, utiliza-se a centrifugação ou a filtração para separar as células do sobrenadante. Subsequentemente, a amostra é submetida a processos de concentração, purificação e polimento para eliminar a maioria das impurezas. Nos casos em que os produtos biofarmacêuticos são segregados extracelularmente no meio de cultura, podem ser submetidos diretamente ao processo de purificação. No entanto, para os biofármacos intracelulares, as células têm de ser submetidas a lise através de sonicação ou de um homogeneizador de alta pressão, seguida de clarificação para remover os resíduos celulares. Além disso, é necessário um passo adicional que envolve a redobragem da proteína através da troca de tampão para obter proteínas recombinantes activas, se estas forem expressas como corpos de inclusão (26).
Nos produtos biofarmacêuticos, a obtenção de um nível de pureza superior a 99% é crucial, e as etapas cromatográficas são normalmente utilizadas devido ao seu uso convencional na purificação e polimento de proteínas, oferecendo uma elevada capacidade de resolução (25, 27). Para a purificação de produtos biofarmacêuticos, são normalmente utilizadas várias classes de técnicas de cromatografia, como as de permuta iónica, afinidade, interacção hidrofóbica, exclusão de tamanho e modo misto (28). No entanto, a cromatografia está frequentemente associada a custos de investimento elevados e a tempos de ciclo longos, o que afecta o rendimento e a escalabilidade da produção de produtos biofarmacêuticos (29). Como alternativas, a precipitação (30), a microfiltração (31, 32), a ultrafiltração (33), a cristalização (34), o sistema de duas fases aquosas (35, 36) e a separação magnética (37, 38) foram também utilizados para o processamento a jusante de produtos biofarmacêuticos. Atualmente, as etapas de processamento a jusante estão a passar de processos descontínuos para processos contínuos, incorporando a utilização de equipamento de utilização única, melhorando o controlo do processo e empregando modelos de redução de escala para um desenvolvimento mais eficiente do processo (39, 40).
Produtos biofarmacêuticos e aplicações clínicas
Os produtos biofarmacêuticos são atualmente muito utilizados no tratamento de numerosas doenças. Nas subsecções seguintes são abordados vários tipos de produtos biofarmacêuticos, incluindo anticorpos monoclonais, vacinas, enzimas, hormonas, terapias celulares, citocinas, factores de crescimento, ácidos nucleicos e hidratos de carbono. Estas diversas categorias de produtos biofarmacêuticos desempenham papéis cruciais no panorama terapêutico, demonstrando a versatilidade e a eficácia desta classe de produtos farmacêuticos.
Anticorpos monoclonais (mAbs)
Os anticorpos monoclonais (mAbs) são anticorpos derivados de um único clone de células B, o que lhes confere monoespecificidade e homogeneidade, tornando-os adequados para aplicações terapêuticas (41). Após a imunização, cada célula B expressa anticorpos específicos para uma determinada região do antigénio (epítopo), o que resulta em ligeiras variações na especificidade do epítopo entre os anticorpos. Os mAbs terapêuticos predominantes pertencem às IgGs devido à sua semi-vida circulante alargada e à facilidade de produção em comparação com as outras classes, como IgM, IgD, IgE e IgA (42). A maioria das terapêuticas com mAbs é utilizada no tratamento de doenças imunológicas, oncológicas e infecciosas. A Tabela 1 apresenta um resumo dos vários tipos de mAbs utilizados para diferentes aplicações terapêuticas, juntamente com os respectivos alvos.
| Tabela 1. mAbs utilizados para aplicações terapêuticas. |
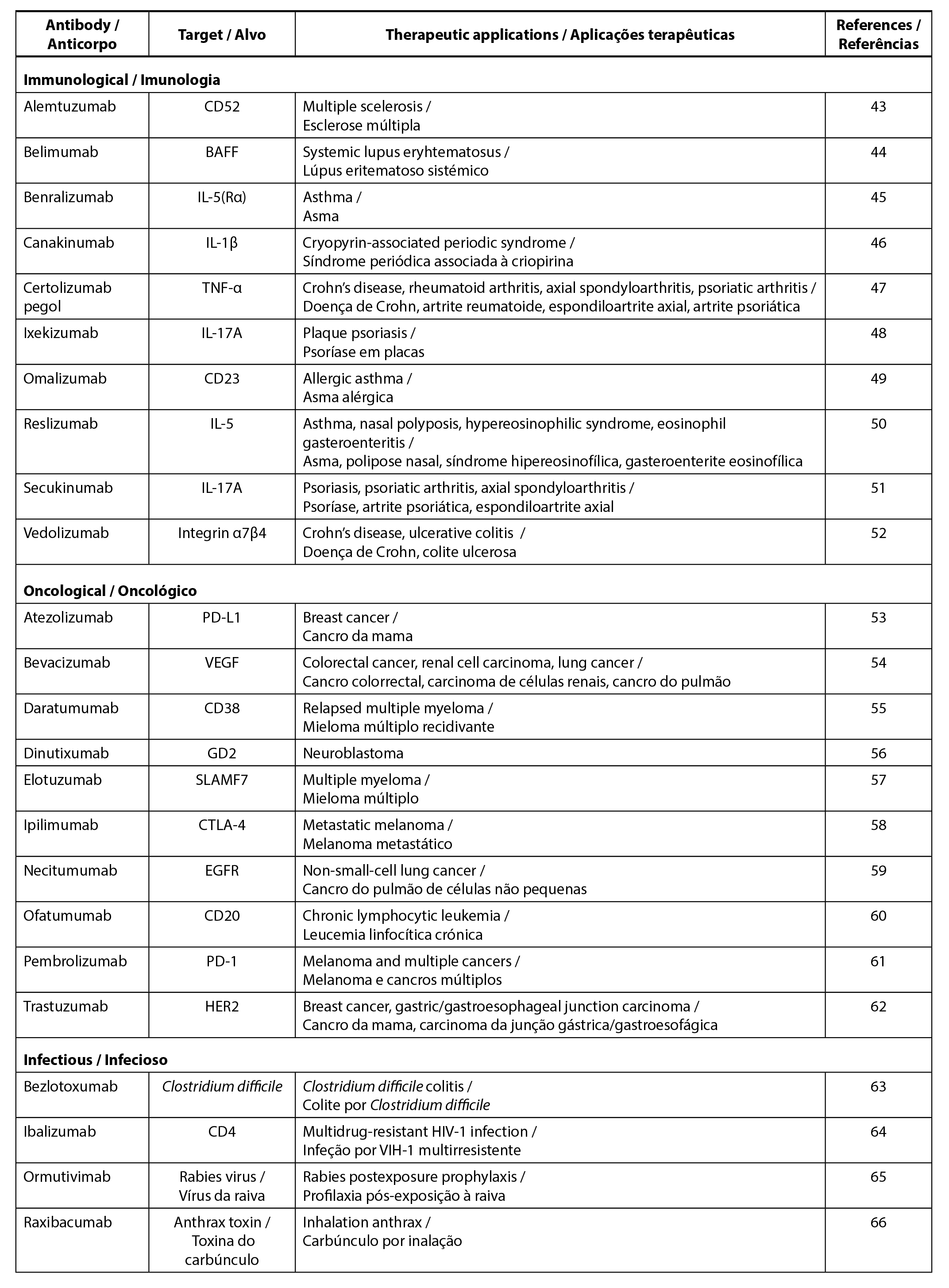 |
No contexto das doenças imunológicas, os mAbs têm como alvo vários componentes do sistema imunitário para minimizar as respostas excessivas características das doenças auto-imunes. Isto envolve acções como o bloqueio das células T ou das células B, a inibição da interação entre as células T e as células apresentadoras de antigénios, a prevenção do recrutamento de células T e de células B, o impedimento da diferenciação e da ativação das células T, bem como o bloqueio das citocinas pró-inflamatórias (67). Um exemplo notável de mAbs terapêuticos é o Adalimumab, o primeiro mAbs IgG1 totalmente humano do mundo, que tem como alvo o TNF-α. O adalimumab é utilizado no tratamento da artrite reumatoide, da psoríase, da artrite psoriática, da doença de Crohn, da colite ulcerosa, da artrite idiopática juvenil e da espondilite anquilosante (10, 68).
Além disso, a imunoterapia baseada em mAbs desempenha um papel crucial na terapêutica anticancerígena, visando os antigénios tumorais e promovendo a indução de respostas imunitárias antitumorais duradouras (69). Os mAbs terapêuticos visam principalmente os receptores de factores de crescimento (por exemplo, EGFR, HER2, etc.) sobre-expressos nas células tumorais, sendo que o bloqueio destes receptores impede a ligação ou a sinalização do ligando. Isto, por sua vez, diminui a taxa de crescimento do tumor, induz a apoptose e sensibiliza os tumores à quimioterapia (70). Além disso, os mAbs funcionam para fornecer radioisótopos de forma selectiva às células cancerígenas e inibir a angiogénese, visando o microambiente tumoral. A terapêutica baseada em mAbs também visa as células imunitárias, inibindo os pontos de controlo imunitário, como o antigénio 4 associado aos linfócitos T citotóxicos (CTLA-4) e a proteína 1 de morte celular programada (PD-1)/ligando 1 de PD-1 (PD-L1), aumentando assim as respostas imunitárias antitumorais (71).
A utilização de mAbs no tratamento de doenças infecciosas oferece várias vantagens, incluindo o baixo risco de transmissão de agentes patogénicos, a baixa variabilidade de lote para lote e complicações imunológicas insignificantes associadas à utilização de soros heterólogos (70). O palivizumab, o primeiro mAbs aprovado para doenças infecciosas, é utilizado para a prevenção de doenças respiratórias resultantes do vírus sincicial respiratório através da inibição da replicação do vírus (72). Outros mAbs, como o erenumab, o fremanezumab e o galcanezumab, têm sido utilizados para o tratamento de enxaquecas (73).
Enzimas
As enzimas emergiram como biofármacos essenciais, encontrando aplicações na terapia enzimática ou na terapia de substituição enzimática para o tratamento de doenças que anteriormente eram difíceis de tratar (74). Estas moléculas biologicamente activas apresentam um potencial catalítico significativo, caracterizado por uma elevada especificidade e afinidade do substrato, baixa toxicidade e efeitos secundários mínimos (75). A catálise enzimática permite a conversão de múltiplos alvos em produtos desejados, permitindo a administração de terapêuticas em pequenas quantidades (76). Os microrganismos desempenham um papel fundamental na produção generalizada de enzimas, devido à sua diversidade fisiológica, geográfica e genómica. As enzimas microbianas tornaram-se um recurso promissor para fins terapêuticos e de diagnóstico no sector da saúde devido à sua consistência, viabilidade económica, facilidade de isolamento e potencial de modificação e otimização do produto. Além disso, os microrganismos podem produzir enzimas com elevados rendimentos, utilizando um meio económico num curto período de tempo, sem os problemas relacionados com as flutuações sazonais (77).
Os anti-inflamatórios enzimáticos são utilizados como alternativas aos anti-inflamatórios não esteróides convencionais (AINE) para o tratamento da inflamação (78). A serratiopeptidase, um agente anti-inflamatório historicamente eficaz, tem sido utilizado na degradação da placa aterosclerótica, na cicatrização de feridas, na redução da viscosidade e da espessura do muco em reacções alérgicas e no controlo da dor cirúrgica. Tem demonstrado aplicações clínicas no tratamento de várias doenças, incluindo doenças da mama, doenças de Alzheimer, sinusite, hepatite, doenças pulmonares, aterosclerose e miomas uterinos (79). A colagenase é outra enzima que pode ser utilizada para produzir péptidos derivados do colagénio, melhorando a quimiotaxia dos macrófagos e aumentando a secreção de citocinas, promovendo assim a cicatrização de feridas. A colagenase tem encontrado aplicações no tratamento da doença de Dupuytren e da doença de Peyronie. Além disso, a superóxido dismutase (SOD) representa um agente anti-inflamatório que transforma os aniões superóxido impermeáveis à membrana em peróxido de hidrogénio difusível à membrana, que pode depois ser desintoxicado pela catalase e pela peroxidase. As SODs interrompem a cascata inflamatória eliminando os radicais livres nocivos, limitando assim a progressão da doença. Estas enzimas são incorporadas em preparações medicamentosas para várias doenças, incluindo a isquemia do miocárdio, a doença de Peyronie, a colite, a esclerose múltipla e o cancro da mama (80).
Os enziobióticos constituem uma classe promissora de antibacterianos únicos que envolvem enzimas como lisinas, autolisinas e lisozimas para combater bactérias patogénicas infecciosas. As lisinas, codificadas por bacteriófagos de ADN de cadeia dupla durante o ciclo lítico, desempenham um papel crucial na clivagem de ligações covalentes na camada de peptidoglicano das paredes celulares bacterianas ou na desestabilização da membrana plasmática bacteriana, levando à morte das bactérias (81). Estudos anteriores utilizaram várias lisinas, tais como Cpl-1, Pal, Ply GBS, PlyC, visando diferentes Streptococcus sp. (75). As autolisinas representam outro tipo de enzimas líticas, sendo a Lyt A amidase a primeira autolisina utilizada como agente antibacteriano para o tratamento de Streptococcus pneumoniae (82). As lisozimas, enzimas hidrolíticas que clivam especificamente as ligações β-1,4 glicosídicas na camada de peptidoglicano, induzem a lise bacteriana (83). As lisozimas apresentam atividade anti-inflamatória, anticancerígena, antibacteriana e antiviral, o que as torna adequadas para aplicações terapêuticas como a cicatrização de feridas e a eliminação de bactérias orais (84, 85).
As enzimas fibrinolíticas microbianas demonstram fibrinólise, um processo que quebra a rede de fibrina dos coágulos sanguíneos sem efeitos secundários, restaurando assim o fluxo sanguíneo normal nos vasos sanguíneos (86). A estreptoquinase, um tipo de fármaco fibrinolítico à base de enzimas, apresenta atividade trombolítica ao formar um complexo ativo com o plasminogénio, que promove a clivagem da ligação arginina-valina no plasminogénio. Isto resulta na formação da enzima proteolítica plasmina que degrada a matriz do trombo, levando à dissolução dos coágulos sanguíneos (75). Outro tipo de enzima fibrinolítica é conhecida como estafiloquinase, que possui uma atividade trombolítica semelhante à da estreptoquinase. A enzima natokinase apresenta uma forte atividade fibrinolítica e pode inativar o inibidor do ativador do plasminogénio-I (PAI-I) (87). A natokinase oferece vantagens em relação a outras enzimas fibrinolíticas devido ao seu potencial para administração oral, efeitos sustentados, estabilidade no trato gastrointestinal e melhor produção de activadores do plasminogénio (88).
Vacinas
As vacinas, uma outra categoria de produtos biofarmacêuticos, desempenham um papel crucial no reforço da resposta imunitária humana contra várias infecções ou doenças. Podem ser obtidas de vários componentes de agentes patogénicos, tais como proteínas de superfície, ácidos nucleicos, glicoproteínas, ou biomanufaturadas (89). Os antigénios que estimulam o sistema imunitário são o principal componente das vacinas, e elementos adicionais como estabilizadores, antibióticos, conservantes, componentes vestigiais, excipientes e adjuvantes são frequentemente adicionados para aumentar a imunogenicidade e melhorar o prazo de validade. As vacinas profiláticas são desenvolvidas principalmente para doenças infecciosas e são normalmente administradas a indivíduos saudáveis para produzir anticorpos para a prevenção de doenças. As vacinas profilácticas têm sido altamente eficazes contra doenças potencialmente mortais, como a varíola e a poliomielite viral (90). Por outro lado, as vacinas terapêuticas são utilizadas como terapia pós-exposição para reforçar o sistema imunitário do indivíduo contra doenças crónicas, doenças pré-malignas ou cancro. Estas vacinas são concebidas para induzir a imunidade mediada por células, induzir a regressão do tumor e erradicar a doença residual mínima (91).
As vacinas vivas atenuadas, um tipo convencional de vacina, demonstraram eficácia contra a tuberculose, a varicela, a gripe, o sarampo, a papeira, o rotavírus e a poliomielite (92). Em contrapartida, as vacinas inteiras inactivadas, que são mais seguras devido à prevenção da replicação e das mutações, são introduzidas para doenças como o poliovírus, o vírus da hepatite A e o vírus da encefalite japonesa (92). As vacinas de partículas semelhantes a vírus são utilizadas para vírus como o vírus do papiloma humano (HPV), o vírus da hepatite B, o vírus da hepatite E, o vírus da gripe, o vírus SARS-CoV-2 e o vírus sincicial respiratório. Estas vacinas são expressas em diferentes sistemas, incluindo leveduras, células de insectos e plantas (93). As vacinas polissacáridas ou conjugadas com polissacáridos, derivadas de polímeros que formam a estrutura capsular de agentes patogénicos bacterianos, protegem contra a doença meningocócica invasiva, a doença pneumocócica e a febre tifoide (94-96).
Novas plataformas de vacinas vêm surgindo para permitir respostas rápidas a agentes patogénicos emergentes, em especial aos agentes patogénicos pandémicos. Estas plataformas foram concebidas para o fabrico em grande escala, com custos reduzidos, uma pegada pequena e uma implantação mais fácil. Os avanços na biologia molecular, na bioinformática e em tecnologias como a sequenciação NexGen contribuem para o desenvolvimento destas plataformas. (89). As vacinas com vetor bacteriano implicam a utilização de células bacterianas vivas não patogénicas, como o Lactobacillus sp., como transportadores para facilitar a administração de vacinas na mucosa. As vacinas vectorizadas por vírus são derivadas de vírus concebidos para codificar genes para antigénios clonados na espinha dorsal do vetor. Estas vacinas são particularmente utilizadas para a produção rápida de vacinas profilácticas durante situações epidémicas ou endémicas (97). Um exemplo é a JNJ-78436735 da Janssen Biotech Inc., uma vacina de vetor viral para o vírus SARS-CoV-2. As vacinas de ADN fornecem genes que codificam antigénios imunogénicos às células do hospedeiro utilizando plasmídeos de ADN como vetor, incluindo uma resposta imunitária humoral e mediada por células (98). As vacinas de ARNm, por outro lado, fornecem ARNm que codifica o antigénio às células imunitárias para desencadear uma resposta imunitária. Exemplos incluem COMINARTY® e SpikeVax® , duas vacinas de ARNm para o vírus SARS-CoV-2.
Células estaminais
A terapia com células estaminais envolve a introdução nas células do corpo para induzir a capacidade auto-regenerativa e de diferenciação, com o objetivo de regenerar células e tecidos danificados ou substituí-los por células novas, saudáveis e totalmente funcionais (99). As células estaminais são classificadas como autólogas, utilizando as células do próprio doente, ou alogénicas, utilizando células de um dador saudável. As células estaminais pluripotentes humanas (hPSC), caracterizadas pela sua capacidade de auto-renovação, têm o potencial de se diferenciar em vários fenótipos celulares para tratar uma vasta gama de doenças (100). Além disso, as células estaminais mesenquimais (MSC), originárias da mesoderme primitiva e das células mesodérmicas auto-renováveis, possuem um potencial de diferenciação multidirecional (101). As hPSC e as MSC são derivadas da medula óssea, do tecido adiposo ou do cordão umbilical para o tratamento de doenças humanas, tais como disfunções pulmonares, doenças metabólicas/endócrinas, perturbações neurológicas, doenças do sistema digestivo, perturbações reprodutivas, doenças cardiovasculares, cicatrização de feridas e queimaduras cutâneas.
Para além das hPSCs e das MSCs, a terapia baseada em células estaminais para doenças do fígado envolve células estaminais hematopoiéticas (HSCs) e células progenitoras do fígado (102). Está provado que a administração de MSCs reduz as lesões ósseas, melhora a regeneração óssea e estimula o processo de vascularização na cartilagem degenerativa, tornando-a um potencial tratamento para a artrite (102). No tratamento do cancro, as MSC demonstram a capacidade de migrar para locais danificados através de um tropismo inerente controlado por factores de crescimento, quimiocinas e citocinas. A capacidade única das MSC para regular a reparação e recuperação dos tecidos contribui para as funções protumoral e antitumoral (99). Na geração de tecido de queimaduras, as MSC contribuem para a geração de queratinócitos e perfis de secreção que melhoram consideravelmente o processo de regeneração da pele (103).
Hormona do crescimento humano
A hormona de crescimento humana (hGH), também conhecida como somatotropina, é libertada na corrente sanguínea e desempenha um papel crucial em numerosas funções biológicas, incluindo o metabolismo dos hidratos de carbono, lípidos e proteínas, a lactação, a regulação imunitária e a proliferação celular (104). A hGH tem diversos efeitos, como a aceleração da cicatrização de feridas, o aumento do fator de crescimento semelhante à insulina (IGF)-1, da osteocalcina, do pró-peptídeo de colagénio tipo I (PICP) e da densidade óssea, bem como o aumento da absorção de cálcio, magnésio e fosfato no organismo (105, 106). Clinicamente, a hGH tem sido utilizada no tratamento de doenças como fracturas ósseas, queimaduras cutâneas, perda de peso relacionada com a SIDA e úlceras hemorrágicas, bem como em doenças como a síndrome de Down, a síndrome de Noonan e a síndrome de Prader-Willi (104, 107). A hGH recombinante apresenta efeitos secundários mínimos, baixa citotoxicidade, elevada seletividade e poucas interacções não específicas, o que a torna uma opção terapêutica valiosa (108).
Citocinas
As citocinas, uma classe distinta de produtos biofarmacêuticos, são proteínas imunoreguladoras responsáveis pela regulação da proliferação, diferenciação e respostas imunitárias das células. As terapias biológicas para o cancro, as doenças auto-imunes, as doenças virais, as doenças infecciosas, as doenças inflamatórias e a esclerose múltipla utilizam frequentemente citocinas como as interleucinas (IL), os interferões (IFN) e os factores de crescimento (109, 110).
A interleucina-2 (IL-2) destaca-se como uma citocina proeminente na terapia de tumores como o melanoma e o cancro renal, activando, diferenciando e mantendo as células T. Inicialmente, estas células T expressam um recetor dimérico de baixa afinidade com cadeias β e γ e, após a ativação das células T, adquirem o recetor de IL-2 trimérico de alta afinidade (IL-2R), que inclui a cadeia α (111). O fator de necrose tumoral-α (TNF-α), outra citocina pró-inflamatória, actua nas células endoteliais para conter as infecções, aumentando a permeabilidade da vasculatura e a coagulação sanguínea. Também atrai e ativa células imunitárias adjacentes, induzindo a apoptose direta de determinadas células tumorais, provocando necrose hemorrágica e aumentando o influxo de células imunitárias efectoras. Consequentemente, o TNF-α é amplamente utilizado na terapia do cancro para o tratamento de sarcomas de tecidos moles e melanomas metastáticos (112). A IL-12, um tipo diferente de citocina, desempenha um papel crucial na regulação das respostas das células T e das células assassinas naturais. Induz a produção de interferão-γ (IFN-γ), promove a diferenciação das células T helper 1 (TH1) e funciona como um elo vital entre a resistência inata e a imunidade adaptativa (113).
Os interferões (IFN) podem ser classificados em Tipo I, II e III com base no tipo de recetor e na sequência de aminoácidos. Entre os IFN de tipo I, o IFN-α foi aprovado para o tratamento do mieloma múltiplo e da hepatite crónica B e C, enquanto o IFN-β é utilizado no tratamento da esclerose múltipla. O IFN de tipo II, IFN-λ, tem-se mostrado promissor como terapia alternativa para doenças como a aterosclerose, a tuberculose, o cancro, as infecções fúngicas e a doença granulomatosa crónica (114). Os IFN de tipo III induzem uma resposta antiviral ou imunomoduladora mais específica, apresentando atividade antiviral contra vários vírus gastrointestinais e respiratórios, incluindo o vírus sincicial respiratório, o vírus da gripe, o rotavírus, o metapneumovírus e o coronavírus (115, 116).
Os factores de crescimento recombinantes têm a capacidade de estimular o crescimento celular e facilitar a cicatrização de feridas normais e patológicas. O fator de crescimento dos hepatócitos, por exemplo, tem sido utilizado no tratamento da doença inflamatória intestinal, promovendo a proliferação dos hepatócitos e modulando a proliferação e a migração das células epiteliais intestinais, o que conduz à rápida reparação das células epiteliais intestinais (117). Além disso, o fator de crescimento endotelial vascular e o fator de crescimento dos fibroblastos revelaram-se eficazes no tratamento da doença arterial coronária (118, 119). A sinalização do fator de crescimento semelhante à insulina nos macrófagos residentes no sistema nervoso central desempenha um papel na regulação da morfologia e do transcriptoma destas células, atenuando assim a gravidade da inflamação autoimune (120). No processo de cicatrização de feridas, vários factores de crescimento actuam através de mecanismos autócrinos, parácrinos ou endócrinos, ligando-se a receptores de membrana ou citoplasmáticos. Isto dá início a uma cascata de eventos que activam a maquinaria celular para facilitar a cicatrização de feridas. Exemplos de factores de crescimento utilizados em aplicações cirúrgicas incluem o fator de crescimento epidérmico, o fator de crescimento dos queratinócitos, o fator de crescimento dos fibroblastos, o fator estimulador das colónias de granulócitos-macrófagos, o fator de crescimento transformador beta, o fator de crescimento derivado das plaquetas e o fator de crescimento endotelial vascular (121, 122).
Ácidos nucleicos
As terapêuticas com ácidos nucleicos (AN) abrangem uma vasta gama de ADN e ARN, incluindo oligonucleótidos, oligonucleótidos antisense, ARN de interferência curta (ARNi) e ARNm (123). Os oligonucleótidos referem-se a moléculas curtas de ADN ou ARN, enquanto os oligonucleótidos antisense são ADN curto de cadeia simples, o ARNi é constituído por ADN pequeno e de cadeia dupla e o ARNm é constituído por milhares de nucleótidos. A Tabela 2 apresenta exemplos de terapêuticas de NA com base na classificação biológica, juntamente com os seus respectivos alvos e aplicações terapêuticas.
| Tabela 2. Exemplos de terapêuticas com ácidos nucleicos. |
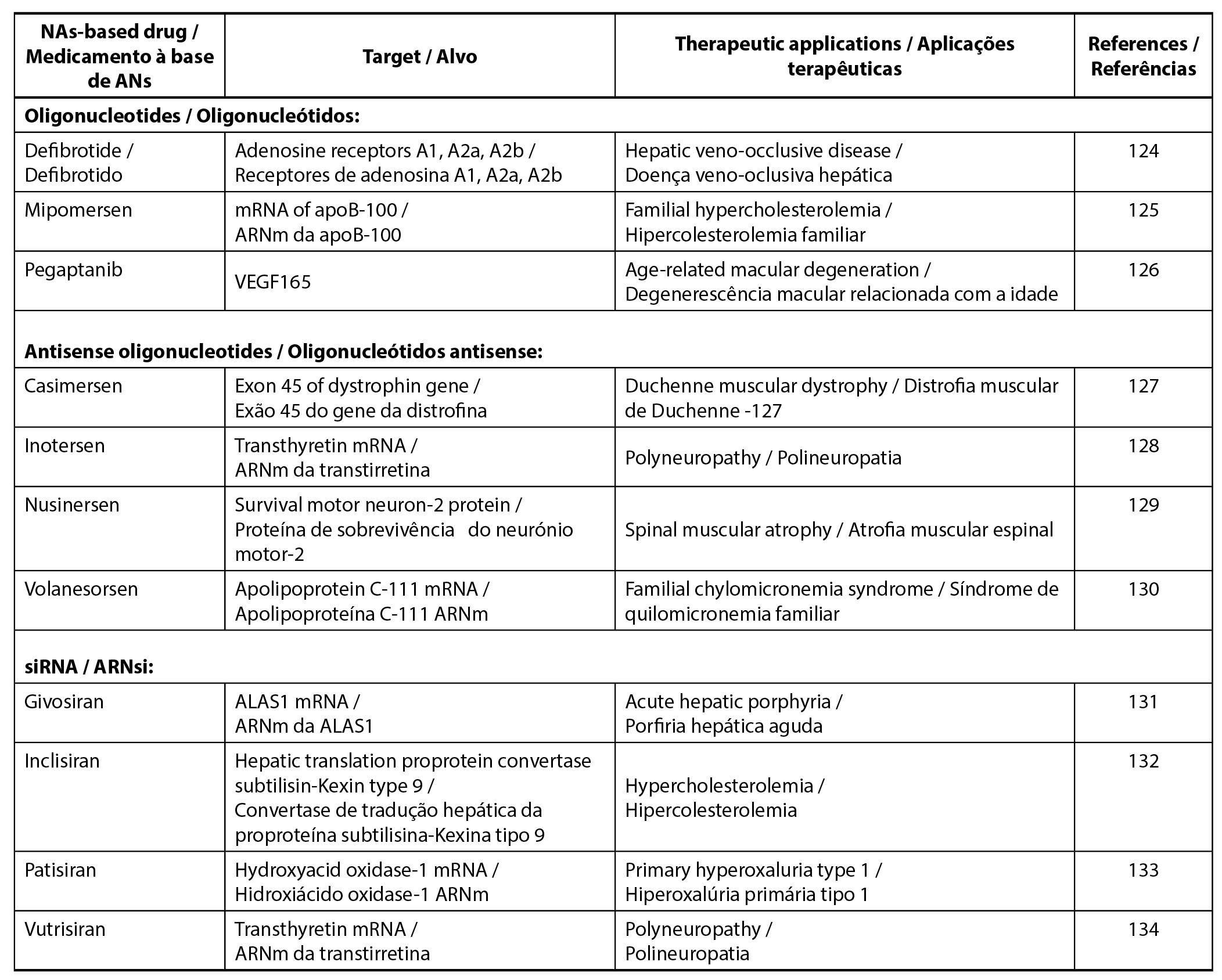 |
Os ANs são diretamente administradas a células ou tecidos-alvo, mas a sua complexidade e elevado grau de hidrofilia colocam frequentemente desafios à sua estabilidade. Os ANs simples e não modificados apresentam meias-vidas curtas devido à degradação enzimática e química. Por conseguinte, o desenvolvimento de formulações de alta qualidade com sistemas eficazes de administração de fármacos é uma salvaguarda para proteger os NA da degradação e garantir o êxito da sua administração às células ou tecidos-alvo (135). As várias opções para estas terapêuticas incluem nanopartículas à base de lípidos, nanopartículas poliméricas, nanopartículas de ouro e nanopartículas porosas. As nanopartículas lipídicas em particular, demonstram uma maior compatibilidade em comparação com as contrapartes poliméricas e metálicas (136). Por exemplo, o Patisiran (Onpattro®) é a primeira formulação de nanopartículas lipídicas disponível no mercado, administrada em vesículas de lipossomas (137). Além disso, as nanopartículas lipídicas têm aplicação nas vacinas de ARNm contra a COVID-19, contribuindo para uma maior estabilidade e eficácia (135).
Hidratos de carbono
As terapêuticas à base de hidratos de carbono desempenham um papel significativo nos tratamentos cardiovasculares e hematológicos, abordando condições que incluem doenças inflamatórias, tratamento antitrombótico e cicatrização de feridas. Os hidratos de carbono caracterizam-se pela elevada densidade de grupos funcionais, estruturas moleculares diversas e biocompatibilidade ideal, uma vez que são omnipresentes no organismo (138). Historicamente, a heparina tem sido utilizada como um agente anticoagulante e antitrombótico injetado por via intravenosa, crucial em cirurgias cardiovasculares e hemodiálise (139). Os oligossacáridos e os polissacáridos têm aplicação no tratamento de doenças do trato gastrointestinal devido à sua baixa lipofilicidade, em que é aceitável uma absorção limitada. Além disso, a lactulose é utilizada no tratamento da obstipação crónica, promovendo a formação de gás intraluminal e facilitando o movimento intestinal (140). Um exemplo de um fármaco de hidratos de carbono puros é a injeção de F-fluorodeoxiglucose (18F-FDG), utilizada para o diagnóstico do cancro, uma vez que este composto pode ser absorvido pelas células tumorais, permitindo a identificação dos locais de tumor e a determinação do estádio do cancro (141)
Além disso, os hidratos de carbono podem servir de conjugados noutros fármacos, aumentando a bioatividade, melhorando as propriedades físico-químicas e permitindo a administração de fármacos específicos. O 18F-FDG, por exemplo, é um componente valioso para a utilização de glicoconjugados em carcinomas da mama, do pulmão, colorrectais e endometriais, bem como em sarcomas dos tecidos moles e dos ossos (142). Os hidratos de carbono são cada vez mais utilizados como estruturas para o desenvolvimento de compostos bioactivos, imitando a espinha dorsal dos péptidos para aumentar a biodisponibilidade. O primeiro composto peptidomimético, baseado na estrutura do β-d-glucósido, exemplifica esta abordagem (143). A aplicação dos hidratos de carbono estende-se ao desenvolvimento de vacinas antimicrobianas e anticancerígenas, sendo a Prevnar 13 uma típica vacina conjugada polissacárido-proteína (144). Além disso, os hidratos de carbono são integrados em nanomateriais para imagiologia biomédica, diagnóstico e terapêutica, afim de aumentar a eficácia dos medicamentos, reduzir a toxicidade inespecífica e melhorar a orientação (145). Os hidratos de carbono contribuem para aumentar a solubilidade em água, melhorar a biocompatibilidade dos nanomateriais e aumentar a afinidade pelos receptores, optimizando assim a utilização dos nanomateriais (138).
Desafios
O rápido avanço dos produtos biofarmacêuticos inovadores abriu uma nova era terapeutica humana, com promissoras perspectivas cientificas e regulatórias. No entanto, persistem desafios no desenvolvimento biofarmacêutico, incluindo preocupações como o custo de processamento dos biofármacos, limitações na conceção de formulações injectáveis e dificuldades em prever a toxicidade humana com base em estudos em animais.
O fabrico de produtos biofarmacêuticos está frequentemente associado a custos elevados, principalmente devido à utilização de tecnologias dispendiosas como a tecnologia do ADN recombinante. Ao contrário de outros produtos farmacêuticos sintéticos e convencionais, o processo de fabrico de produtos biofarmacêuticos é turtuoso, envolvendo o isolamento, o crescimento e a reprodução de organismos vivos. O processamento a jusante da produção biofarmacêutica é responsável por cerca de 80% dos custos globais de produção. Esta complexidade apresenta desafios para garantir a segurança, a qualidade e a eficácia. Além disso, a embalagem de produtos biofarmacêuticos tem de cumprir requisitos rigorosos para garantir a estabilidade dos compostos biológicos até à sua administração. Estes compostos são particularmente sensíveis a alterações de temperatura e a factores ambientais. A implementação do processamento contínuo tem o potencial de enfrentar estes desafios, reduzindo os custos de capital, aumentando a rentabilidade e a produtividade e melhorando a qualidade e a flexibilidade do produto. É importante realizar análises económicas para avaliar a relação custo-eficácia do processamento contínuo e explorar processos inovadores alternativos e rentáveis para a produção biofarmacêutica (146).
Dado que a injeção é o principal modo de administração dos biofármacos, devido à sua fraca permeabilidade às membranas, a conceção de uma formulação injetável apresenta desafios que não são comuns a outros medicamentos de pequenas moléculas. A baixa estabilidade dos biofármacos, resultante de modificações estruturais ou de factores ambientais, exige a utilização de estabilizadores na sua formulação. No entanto, é essencial uma análise cuidadosa em termos de toxicidade local e de imunogenicidade potencial. É fundamental compreender o mecanismo de inativação dos medicamentos biofarmacêuticos e avaliar a adequação dos excipientes utilizados na formulação para estabilização. A viscosidade elevada e variável dos fármacos biofarmacêuticos que contêm soluções proteicas de várias centenas de miligramas por mililitro torna a administração do fármaco difícil, pelo que a criação de formulações de baixa viscosidade constitui um desafio significativo (8).
Os estudos em animais efectuados durante o desenvolvimento de produtos biofarmacêuticos colocam desafios na previsão da toxicidade humana. Esta dificuldade resulta de factores como a reatividade cruzada, a farmacologia potencialmente exagerada e as respostas imunogénicas observadas em animais, que podem não prever com precisão a imunogenicidade em seres humanos. A perspetiva de reacções imunitárias adversas pode ter consequências clínicas, incluindo o risco de anafilaxia, a redução da semi-vida do medicamento e a neutralização dos biofármacos e dos seus análogos humanos endógenos. Por conseguinte, são necessárias alternativas aos estudos em animais, incluindo testes in vitro, como amostras de tecidos ou linhas celulares, organismos alternativos, como as bactérias, e tecnologias avançadas, como as tecnologias de órgãos em chip, como a modelação por computador ou os ensaios de microdosagem em humanos de fase 0 (147).
Conclusão
Os produtos biofarmacêuticos apresentam inúmeras vantagens em aplicações terapêuticas, contribuindo efetivamente para a prevenção, tratamento e diagnóstico de doenças. A atual gama de produtos biofarmacêuticos clínicos, incluindo mAbs, enzimas, vacinas, células estaminais, hormonas de crescimento humano, citocinas, ácidos nucleicos e hidratos de carbono, sublinha a sua versatilidade e potencial impacto. Esta revisão apresenta conhecimentos importantes, actualizados, sobre os produtos biofarmacêuticos, oferecendo uma visão que pode informar a tomada de decisões, o desenvolvimento de políticas e a investigação futura no domínio dos cuidados de saúde e dos produtos farmacêuticos.
Contribuição dos autores
Kai Bin Liew: Conceptualização, Redação - Rascunho original, Supervisão. Siew Keah Lee: Investigação, Redação - Rascunho original. Long Chiau Ming: Investigação, Redação - Rascunho original. Zaidul Islam Sarker: Análise formal, Redação - Projeto original. A.B.M. Helal Uddin: Curadoria de dados, Redação - Revisão e edição. Yik Ling Chew: Recursos, Redação - Revisão e edição. Phei Er Kee: Visualização, Escrita - Revisão e edição.
Financiamento
Este trabalho foi apoiado pelo Ministério do Ensino Superior da Malásia (MOHE), Regime de Subvenções à Investigação Fundamental (FRGS) (subvenção n.º: FRGS/1/2021/SKK0/UOC/02/2).
Agradecimentos
Gostaríamos de agradecer a todos os actores e instituições envolvidas que nos deram a oportunidade e disponibilizaram as suas instalações para a realização deste estudo.
Conflito de interesses
Os autores declaram não haver conflito de interesses relativamente a este trabalho.
Referências
1. González Peña, O.I., López Zavala, M. Á., & Cabral Ruelas, H. (2021). Pharmaceuticals Market, Consumption Trends and Disease Incidence Are Not Driving the Pharmaceutical Research on Water and Wastewater. International journal of environmental research and public health, 18(5), 2523. 10.3390/ijerph18052532
2. O’Flaherty, R., Bergin, A., Flampouri, E., Mota, L.M., Obaidi, I., Quigley, A., Xie, Y., & Butler, M. (2020). Mammalian Cell Culture for Production of Recombinant Proteins: A review of the Critical Steps in Their Biomanufacturing. Biotechnology advances, 1(43), 107552. 10.1016/j.biotechadv.2020.107552
3. Ghanemi, K., & Yan, S. (2017). Biopharmaceutical Innovation: Benefits and Challenges. Open access journal of science, 1(1), 00004. 10.15406/oajs.2017.01.00004
4. Walsh, G. (2018). Biopharmaceutical Benchmarks 2018. Nature biotechnology, 36(12), 1136-45. 10.1038/nbt.4305
5. Misra, M. (2012). Biosimilars: Current Perspectives and Future Implications. Indian journal of Pharmacology, 44(1), 12-14. 10.4103/0253-7613.91859
6. Kesik-Brodacka, M. (2018). Progress in Biopharmaceutical Development. Biotechnology and applied biochemistry, 65(3), 306-322. 10.1002/bab.1617
7. Skalko-Basnet, N. (2014). Biologics: The Role of Delivery Systems in Improved Therapy. Biologics, 8, 107-114. 10.2147/BTT.S38387
8. Mitragotri, S., Burke, P.A., & Langer, R. (2014). Overcoming the Challenges in Administering Biopharmaceuticals: Formulation and Delivery Strategies. Nature reviews drug discovery, 13(9), 655-672. 10.1038/nrd4363
9. Gronemeyer, P., Ditz, R., & Strube, J. (2014). Trends in Upstream and Downstream Process Development for Antibody Manufacturing. Bioengineering (Basel), 1(4), 188-212. 10.3390/bioengineering1040188
10. Jozala, A.F., Geraldes, D.C., Tundisi, L.L., Feitosa, V.A., Breyer, C.A., Cardoso, S.L., Mazzola, P.G., de Oliveira-Nascimento, L, de Oliveira Rangel-Yagui, de Oliveira Magalhães, P., de Oliveira, M.A., & Jr A.P. (2016). Biopharmaceuticals from Microorganisms: From Production to Purification. Brazalian journal of microbiology, 47 (Suppl 1), 51-63. 10.1016/j.bjm.2016.10.007
11. Tavares, A.P.M., Neves, M.C., Trindade, T., & Freire, M,G. (2020). Recovery and Purification of (Bio)Pharmaceuticals Using (Nano)Materials. Recent advances in analytical techniques, 4, 58-93. 10.2174/9789811405112120040005
12. Zhang, Z.X., Nong, F.T., Wang, Y.Z., Yan, C.X., Gu, Y., Song, P., & Sun, X.-M. (2022). Strategies for Efficient Production of Recombinant Proteins in Escherichia coli: Alleviating the Host Burden and Enhancing Protein Activity. Microbial cell factories, 21(1), 191. 10.1186/s12934-022-01917-y
13. Bhatwa, A., Wang, W., Hassan, Y.I., Abraham, N., Li, X.Z., & Zhou, T. (2021). Challenges Associated With the Formation of Recombinant Protein Inclusion Bodies in Escherichia coli and Strategies to Address Them for Industrial Applications. Frontiers in bioengineering and biotechnology, 9, 630551. 10.3389/fbioe.2021.630551
14. Baeshen, N.A., Baeshen, M.N., Sheikh, A., Bora, R.S., Ahmed, M.M., Ramadan, H.A., Saini, K.S., & Redwan, E.M. (2014). Cell Factories for Insulin Production. Microbial cell factories, 13, 141. 10.1186/s12934-014-0141-0
15. Hou, J., Tyo, K.E.J., Liu, Z., Petranovic, D., & Nielsen, J. (2014). Metabolic Engineering of Recombinant Protein Secretion by Saccharomyces cerevisiae. FEMS yeast research, 12(5), 491-510. 10.1111/j.1567-1364.2012.00810.x
16. Polez, S., Origi, D., Zahariev, S., Guarnaccia, C., Tisminetzky, S.G., Skoko, N., & Baralle, M. (2016). A Simplified and Efficient Process for Insulin Production in Pichia pastoris. PLoS one, 11(12), e0167207. 10.1371/journal.pone.0167207
17. Nielsen, J. (2013). Production of Biopharmaceutical Proteins By Yeast: Advances Through Metabolic Engineering. Bioengineered, 4(4), 207-211. 10.4161/bioe.22856
18. Kantargjieff, A., & Zhou, W. (2013). Mammalian Cell Cultures for Biologics Manufacturing Preface, Advance in biochemical engineering and biotechnology, 139, 1-9. 10.1007/10_2013_255
19. Dumont, J., Euwart, D., Mei, B., Estes, S., & Kshirsagar, R. (2016). Human Cell Lines for Biopharmaceutical Manufacturing: History, Status, and Future Perspectives. Critical reviews in biotechnology. 36(6), 1110-1122. 10.3109/07388551.2015.1084266
20. Glinšek, K., Bozovičar, K., & Bratkovič, T. (2023). CRISPR Technologies in Chinese Hamster Ovary Cell Line Engineering. International journal of molecular sciences, 24(9), 8144. 10.3390/ijms24098144
21. Mitra, S., & Tomar, P.C. (2021). Hybridoma Technology; Advancements, Clinical Significance, and Future Aspects. Journal of genetic engineering and biotechnology, 19(1), 159. 10.1186/s43141-021-00264-6
22. Parray, H.A., Shukla, S., Samal, S., Shrivastava, T., Ahmed, S., Sharma, C., & Kumar, R. (2020). Hybridoma Technology A Versatile Method for Isolation of Monoclonal Antibodies, Its Applicability Across Species, Limitations, Advancement and Future Perspectives. International immunopharmacology, 85, 106639. 10.1016/j.intimp.2020.106639
23. Muyldermans, S., & Smider, V.V. (2016). Distinct Antibody Species: Structural Differences Creating Therapeutic Opportunities. Current opinion in immunology, 40, 7-13. 10.1016/j.coi.2016.02.003
24. Weber, J., Peng, H., & Rader, C. (2017). From Rabbit Antibody Repertoires To Rabbit Monoclonal Antibodies. Experimental & molecular medicine, 49(3), e305. 10.1038/emm.2017.23
25. Fields, C., Li, P., O'Mahony, J.J. & Lee, G.U. (2106). Advances in Affinity Ligand-Functionalized Nanomaterials for Biomagnetic Separation. Biotechnology & bioengineering, 113(1), 11-25. 10.1002/bit.25665
26. Yamaguchi, H., & Miyazaki, M. (2014). Refolding Techniques for Recovering Biologically Active Recombinant Proteins from Inclusion Bodies. Biomolecules, 4(1), 235-251. 10.3390/biom4010235
27. Liu, H.F., Ma, J., Winter, C., & Bayer, R. (2010). Recovery and Purification Process Development for Monoclonal Antibody Production. MAbs, 2(5), 480-499. 10.4161/mabs.2.5.12645
28. Faria, R.P.V., & Rodrigues, A.E. (2015). Instrumental Aspects of Simulated Moving Bed chromatography. Journal of chromatography A, 1421, 82-102. 10.1016/j.chroma.2015.08.045
29. Rosa, P.A.J., Ferreira, I.F., Azevedo, A.M., & Aires-Barros, M.R. (2010). Aqueous Two-Phase Systems: A Viable Platform in the Manufacturing of Biopharmaceuticals. Journal of chromatography A, 1217(16), 2296-2305. 10.1016/j.chroma.2009.11.034
30. Dutra, G., Komuczki, D., Jungbauer, A., & Satzer, P. (2020). Continuous Capture of Recombinant Antibodies by ZnCl2 Precipitation Without Polyethylene Glycol. Engineering in life sciences, 20(7), 265-274. 10.1002/elsc.201900160
31. Burgstaller, D., Jungbauer, A., & Satzer, P. (2019). Continuous Integrated Antibody Precipitation With Two-Stage Tangential Flow Microfiltration Enables Constant Mass Flow. Biotechnology and bioengineering, 116(5), 1053-1065. 10.1002/bit.26922
32. Li, Z., Gu, Q., Coffman, J.L., Przybycien, T., & Zydney, A.L. (2019). Continuous Precipitation For Monoclonal Antibody Capture Using Countercurrent Washing by Microfiltration. Biotechnology progress, 235(6), e2886. 10.1002/btpr.2886
33. Thakur, G., & Rathore, A.S. (2021). Modelling and Optimization of Single-Pass Tangential Flow Ultrafiltration for Continuous Manufacturing of Monoclonal Antibodies. Separation and purification technology, 276, 119341. 10.1016/j.seppur.2021.119341
34. Chen, W., Li, X., Guo, M., Link, F.J., Ramli, S.S., Ouyang, J., Rosbottom, I., & Heng, J.Y.Y. (2021). Biopurification of Monoclonal Antibody (mAb) Through Crystallisation. Separation and purification technology, 263, 118358. 10.1016/j.seppur.2021.118358
35. Kruse, T., Kampmann, M., Rüddel, I., & Greller, G. (2020). An Alternative Downstream Process Based on Aqueous Two-Phase Extraction for the Purification of Monoclonal Antibodies. Biochemical engineering journal, 161, 107703. 10.1016/j.bej.2020.107703
36. Ornelas-González, A., Reisenauer, S.U., González-González, M., & Rito-Palomares, M. (2020). Characterization and Optimization of Immunoaffinity Aqueous Two-Phase Systems with PEGylated CD133/2-Biotin Antibody in Route to Stem Cell Separation. Journal of chemical technology & biotechnology, 95(1), 123-131. https://doi.org/10.1002/jctb.6213
37. Zanker, A.A., Stargardt, P., Kurzbach, S.C., Turrina, C., Mairhofer, J., Schwaminger, S.P., & Borensmeier, C. (2022). Direct Capture and Selective Elution of A Secreted Polyglutamate-tagged Nanobody Using Bare Magnetic Nanoparticles. Biotechnology journal, 17(5):2100577. 10.1002/biot.202100577
38. Schwaminger, S.P., Blank-Shim, S.A., Scheifele, I., Pipich, V., Fraga-García, P., & Berensmeier, S. (2019). Design of Interactions Between Nanomaterials and Proteins: A Highly Affine Peptide Tag to Bare Iron Oxide Nanoparticles for Magnetic Protein Separation. Biotechnology journal, 14(3), 1800055. 10.1002/biot.201800055
39. Gerstweiler, L., Bi, J., Middelberg, A.P.J. (2021). Continuous Downstream Bioprocessing for Intensified Manufacture of Biopharmaceuticals and Antibodies. Chemical engineering science, 231, 116272. 10.1016/j.ces.2020.116272
40. Strube, J., Ditz, R., Kornecki, M., Huter, M., Schmidt, A., Thiess, H., & Zobel-Roos, S. (2018). Process Intensification in Biologics Manufacturing. Chemical engineering and processing - process intensification, 133, 278-293. 10.1016/j.cep.2018.09.022
41. Lu, R.-M., Hwang, Y.-C., Liu, I.J., Lee, C.-C., Tsai, H.-Z., Li, H.-J., & Wu, H.-C. (2020). Development of Therapeutic Antibodies for the Treatment of Diseases. Journal of biomedical science, 27(1), 1. 10.1186/s12929-019-0592-z
42. Ryman, J.T., & Meibohm, B. (2017). Pharmacokinetics of Monoclonal Antibodies. CPT Pharmacometrics & Systems Pharmacology, 6(9), 576-588. 10.1002/psp4.12224
43. Hu, Y., Turner, M.J., Shields, J., Gale, M.S., Hutto, E., Roberts, B.L., Siders, W.M., & Kaplan, J.M. (2009). Investigation of the Mechanism of Action of Alemtuzumab in A Human CD52 Transgenic Mouse Model. Immunology, 128(2), 260-270. 10.1111/j.1365-2567.2009.03115.x
44. Ramsköld, D., Parodis, I., Lakshmikanth, T., Sippl, N., Khademi, M., Chen, Y., Zickert, A., Mikeš, J., Achour, A., Amara, K., Piehl, F., Brodin, P., Gunnarsson, I., & Malmström, V. (2019). B Cell Alterations During BAFF Inhibition With Belimumab in SLE. EBioMedicine, 40, 517-527. 10.1016/j.ebiom.2018.12.035
45. Ghazi, A., Trikha, A., Calhoun, W.J. (2012). Benralizumab--A Humanized mAb to IL-5Rα With Enhanced Antibody-Dependent Cell-Mediated Cytotoxicity--A Novel Approach for the Treatment of Asthma. Expert opinion biological therapy, 12(1), 113-118. 10.1517/14712598.2012.642359
46. Kuemmerle-Deschner, J.B., & Haug, I. (2013). Canakinumab in Patients With Cryopyrin-Associated Periodic Syndrome: An Update for Clinicians. Therapeutic advances in musculoskeletal disease, 5(6), 315-329. 10.1177/1759720X13502629
47. Curtis, J.R., Mariette, X., Gaujoux-Viala, C., Blauvelt, A., Kvien, T.K., Sandborn, W.J., Winthrop, K., de Longueville, M., Huybrechts, I., & Bykerk, V.P. (2019). Long-Term Safety of Certolizumab Pegol in Rheumatoid Arthritis, Axial Spondyloarthritis, Psoriatic Arthritis, Psoriasis and Crohn's Disease: A Pooled Analysis of 11 317 Patients Across Clinical Trials. RMD open, 5(1), e000942. 10.1136/rmdopen-2019-000942
48. Demirel Öğüt, N., Koç Yıldırım, S., Erbağcı, E., & Hapa, F.A. (2022). Ixekizumab Treatment in Patients With Moderate-To-Severe Plaque Psoriasis in A Real-World Clinical Setting. Journal of cosmetic dermatology, 21(11), 6215-6224. 10.1111/jocd.15217
49. Gon, Y., Maruoka, S., & Mizumura, K. (2022). Omalizumab and IgE in the Control of Severe Allergic Asthma. Frontiers in pharmacology, 13, 839011. 10.3389/fphar.2022.839011
50. Walsh, G.M. (2013). Profile of Reslizumab in Eosinophilic Disease and Its Potential in the Treatment of Poorly Controlled Eosinophilic Asthma. Biologics, 7, 7-11. 10.2147/BTT.S30133
51. Kolbinger, F., Di Padova, F., Deodhar, A., Hawkes, J.E., Huppertz, C., Kuiper, T., Mclnnes, I.B., Ritchlin, C.T., Rosmarin, D., Schett, G., Carballido, J.M., Häusermann, P., Calonder, C., Vogel, B., Rondeau, J.-M., & Bruin, G. (2022). Secukinumab for the Treatment of Psoriasis, Psoriatic Arthritis, and Axial Spondyloarthritis: Physical and Pharmacological Properties Underlie the Observed Clinical Efficacy and Safety. Pharmacology & therapeutics, 229, 107925. 10.1016/j.pharmthera.2021.107925
52. Cherry, L.N., Yunker, N.S., Lambert, E.R., Vaughan, D. & Lowe, D.K. (2015). Vedolizumab: An α4β7 Integrin Antagonist for Ulcerative Colitis and Crohn's Disease. Therapeutic advances in chronic disease, 6(5), 224-233. 10.1177/2040622315586970
53. Ameri, A., Tavakoli-Far, B., Rostami, M., Abedi Kiasari, B., Sakhaei, D., Saad Ahmed, O., Forouzani, F., & Fazli, Y. (2022). Recent Advances in Atezolizumab-Based Programmed Death-Ligand 1 (PD-L1) Blockade Therapy for Breast Cancer. International immunopharmacology, 113(Pt A), 109334. 10.1016/j.intimp.2022.109334
54. Hegde, P.S., Jubb, A.M., Chen, D., Li, N.F., Meng, Y.G., Bernaards, C., Elliott, R., Scherer, S.J., & Chen, D.S. (2013). Predictive Impact of Circulating Vascular Endothelial Growth Factor in Four Phase III Trials Evaluating Bevacizumab. Clinical cancer research, 19(4), 929-937. 10.1158/1078-0432.CCR-12-2535
55. Raedler, L.A. (2016). Darzalex (Daratumumab): First Anti-CD38 Monoclonal Antibody Approved for Patients with Relapsed Multiple Myeloma. American health & drug benefits, 9(Spec Feature), 70-73. 27668047
56. Ploessl, C., Pan, A., Maples, K.T., & Lowe, D.K. (2016). Dinutuximab: An Anti-GD2 Monoclonal Antibody for High-Risk Neuroblastoma. Annals of pharmacotherapy, 50(5), 416-422. 10.1177/1060028016632013
57. Wang, Y., Sanchez, L., Siegel, D.S., & Wang, M.L. (2016). Elotuzumab for the Treatment of Multiple Myeloma. Journal of hematology & oncology, 9(1), 55. 10.1186/s13045-016-0284-z
58. Savoia, P., Astrua, C., & Fava, P. (2016). Ipilimumab (Anti-Ctla-4 Mab) in the Treatment of Metastatic Melanoma: Effectiveness and Toxicity Management. Human Vaccines & Immunotherapeutics, 12(5), 1092-1101. 10.1080/21645515.2015.1129478
59. Thakur, M.K. & Wozniak, A.J. (2017). Spotlight on Necitumumab in the Treatment of Non-Small-Cell Lung Carcinoma. Lung Cancer (Auckl), 8, 13-19. 10.2147/LCTT.S104207
60. Barth, M.J., & Czuczman, M.S. (2013). Ofatumumab: A Novel, Fully Human Anti-CD20 Monoclonal Antibody for the Treatment of Chronic Lymphocytic Leukemia. Future oncology, 9(12), 1829-1839. 10.2217/fon.13.219
61. Burns, M.C., O'Donnell, A., & Puzanov, I. (2016). Pembrolizumab for the Treatment of Advanced Melanoma. Expert opinion on orphan drugs, 4(8), 867-873. 10.1080/21678707.2016.1191348
62. Ross, J.S., & Mulcahy, M. (2011). HER2 Testing in Gastric/Gastroesophageal Junction Adenocarcinomas: Unique Features of a Familiar Test. Gastrointestinal Cancer Research, 4(2), 62-66. 10.1152/ajpcell.00650.2009
63. Navalkele, B.D., & Chopra, T. (2018). Bezlotoxumab: An Emerging Monoclonal Antibody Therapy for Prevention of Recurrent Clostridium difficile Infection. Biologics, 12, 11-21. 10.2147/BTT.S127099
64. Emu, B., Fessel, J., Schrader, S., Kumar, P., Richmond, G., Win, S., Weinheimer, S., Marsolais, C., & Lewis, S. (2018). Phase 3 Study of Ibalizumab for Multidrug-Resistant HIV-1. The new England journal of medicine, 379(7), 645-654. 10.1056/NEJMoa1711460
65. Liu, X., Li, Y., Li, J., Zhou, J., Guo, J., Pu, Y., Jiang, Y., Zhou, Y., Jiang, Z., Shu, Q., Wang, C., Wang, J., Zhao, Y., Zhao, W., Wang, H., Wei, J., Yu, H., Gao, J., & Li, X. (2023). Comparing Recombinant Human Rabies Monoclonal Antibody (Ormutivimab) With Human Rabies Immunoglobulin (HRIG) for Postexposure Prophylaxis: A Phase III, Randomized, Double-blind, Non-inferiority Trial. International journal of infectious diseases, 134, 53-62. 10.1016/j.ijid.2023.05.017
66. Kummerfeldt, C.E. (2014). Raxibacumab: Potential Role in the Treatment of Inhalational Anthrax. Infection and drug resistance, 7, 101-109. 10.2147/IDR.S47305
67. Bruno, V., Battaglia, G., & Nicoletti, F. (2011). The Advent of Monoclonal Antibodies in the Treatment of Chronic Autoimmune Diseases. Neurological Sciences, 31 Suppl 3, 283-288. 10.1007/s10072-010-0382-6
68. Ellis, C.R., & Azmat, C.E. (2023). Adalimumab. In: StatPearls. Treasure Island (FL): StatPearls Publishing LLC.
69. Zahavi, D., & Weiner, L. (2020). Monoclonal Antibodies in Cancer Therapy. Antibodies (Basel), 9(3), 34. 10.3390/antib9030034
70. Castelli, M.S., McGonigle, P., & Hornby, P.J. (2019). The Pharmacology and Therapeutic Applications of Monoclonal Antibodies. Pharmacology research & perspect, 7(6), e00535. 10.1002/prp2.535
71. Lee, J.Y., Lee, H.T., Shin, W., Chae, J., Choi, J., Kim, S.H., Lim, H., Heo, T.W., Park, K.Y., Lee, Y.J., Ryu, S.E., Son, J.Y., Lee, J.U., & Heo, Y.-S. (2016). Structural Basis of Checkpoint Blockade by Monoclonal Antibodies in Cancer Immunotherapy. Nature communications, 7(1), 13354. 10.1038/ncomms13354
72. Rogovik, A.L., Carleton, B., Solimano, A., & Goldman, R.D. (2010). Palivizumab for the prevention of respiratory syncytial virus infection. Canadian family physician, 56(8), 769-772.
73. Aditya, S., & Rattan, A. (2023). Advances in CGRP Monoclonal Antibodies as Migraine Therapy: A Narrative Review. Saudi journal of medicine & medical sciences, 11(1), 11-18. 10.4103/sjmms.sjmms_95_22
74. Li, M. (2018). Enzyme Replacement Therapy: A Review and Its Role in Treating Lysosomal Storage Diseases. Pediatric Annals, 47(5), e191-e197. 10.3928/19382359-20180424-01
75. Vachher, M., Sen, A., Kapila, R., & Nigam, A. (2021). Microbial Therapeutic Enzymes: A Promising Area of Biopharmaceuticals. Current research in biotechnology, 3, 195-208. 10.1016/j.crbiot.2021.05.006
76. Yari, M., Ghoshoon, M.B., Vakili, B., & Ghasemi, Y. (2017). Therapeutic Enzymes: Applications and Approaches to Pharmacological Improvement. Current Pharmaceutical Biotechnology, 18(7), 531-540. 10.2174/1389201018666170808150742
77. Gurung, N., Ray, S., Bose, S., & Rai, V. (2013). A Broader View: Microbial Enzymes and Their Relevance in Industries, Medicine, and Beyond. Biomed research international, 2013, 329121. 10.1155/2013/329121
78. Tiwari, M. (2017). The Role of Serratiopeptidase in the Resolution of Inflammation. Asian journal of pharmaceutical sciences, 12(3), 209-215. 10.1016/j.ajps.2017.01.003
79. Jadhav, S.B., Shah, N., Rathi, A., Rathi, V., & Rathi, A. (2020). Serratiopeptidase: Insights into the Therapeutic Applications. Biotechnol reports, 28, e00544. 10.1016/j.btre.2020.e00544
80. Ünlü, A.E., & Takaç, S. Improvement of Superoxide Dismutase Activity Using Experimental Design and Radical Promoters. Biotechnology & biotechnological equipment, 31(5), 1046-1054. 10.1080/13102818.2017.1353923
81. Ghose, C., & Euler, C.W. (2020). Gram-Negative Bacterial Lysins. Antibiotics (Basel), 9(2), 74. 10.3390/antibiotics9020074
82. Rodríguez-Cerrato, V., García, P., Huelves, L., García, E., Del Prado, G., Gracia, M., Ponte, C., López, R., & Soriano, F. (2007). Pneumococcal LytA Autolysin, A Potent Therapeutic Agent in Experimental Peritonitis-Sepsis Caused by Highly Beta-Lactam-Resistant Streptococcus pneumoniae. Antimicrobial Agents and Chemotherapy, 51(9), 3371-3373. 10.1128/AAC.00137-07
83. Nawaz, N., Wen, S., Wang, F., Nawaz, S., Raza, J., Iftikhar, M., & Usman, M. (2022). Lysozyme and Its Application as Antibacterial Agent in Food Industry. Molecules, 27(19), 6305. 10.3390/molecules27196305
84. Gil-Montoya, J.A., Guardia-López, I., & González-Moles, M.A. (2008). Evaluation of the Clinical Efficacy of A Mouthwash And Oral Gel Containing the Antimicrobial Proteins Lactoperoxidase, Lysozyme and Lactoferrin in Elderly Patients with Dry Mouth – A Pilot Study. Gerodontology, 25(1), 3-9. 10.1111/j.1741-2358.2007.00197.x
85. Chen, Q., Li, W., Wang, J., Qu, X., & Wang, G. (2018). Lysozyme-Antimicrobial Peptide Fusion Protein Promotes the Diabetic Wound Size Reduction in Streptozotocin (STZ)-Induced Diabetic Rats. Medical science monitor, 24, 8449-8458. 10.12659/MSM.912596
86. Altaf, F., Wu, S., & Kasim, V. (2021). Role of Fibrinolytic Enzymes in Anti-Thrombosis Therapy. Frontiers in Molecular Biosciences, 8, 680397. 10.3389/fmolb.2021.680397
87. Chen, H., McGowan, E.M., Ren, N., Lal, S., Nassif, N., Shad-Kaneez, F., Qu, X., & Lin, Y. (2018). Nattokinase: A Promising Alternative in Prevention and Treatment of Cardiovascular Diseases. Biomark Insights, 13, 1177271918785130. 10.1177/1177271918785130
88. Kurosawa, Y., Nirengi, S., Homma, T., Esaki, K., Ohta, M., Clark, J.F., Hamaoka, T. (2015). A Single-Dose of Oral Nattokinase Potentiates Thrombolysis and Anti-Coagulation Profiles. Scientific reports, 5(1), 11601. 10.1038/srep11601
89. Ghattas, M., Dwivedi, G., Lavertu, M., & Alameh, M.G. (2021). Vaccine Technologies and Platforms for Infectious Diseases: Current Progress, Challenges, and Opportunities. Vaccines (Basel), 9(12), 1490. 10.3390/vaccines9121490
90. Kayser, V., & Ramzan, I. (2021). Vaccines and Vaccination: History and Emerging Issues. Human vaccines & immunotherapeutics, 17(12), 5255-5268. 10.1080/21645515.2021.1977057
91. Saxena, M., van der Burg, S.H., Melief, C.J.M., & Bhardwaj, N. (2021). Therapeutic Cancer Vaccines. Nature reviews cancer, 21(6), 360-378. 10.1038/s41568-021-00346-0
92. Aldossary, A.M., Ekweremadu, C.S.M., Offe, I.M., Alfassam, H.A., Han, S., Onyali, V.C., Ozoude, C.H., Ayeni, E.A., Nwagwu, C.S., Halwani, A.A., Almozain, N.H., & Tawfil, E.A. (2022). A Guide to Oral Vaccination: Highlighting Electrospraying as A Promising Manufacturing Technique Toward a Successful Oral Vaccine Development. Saudi pharmaceutical journal, 30(6), 655-668. 10.1016/j.jsps.2022.03.010
93. Nooraei, S., Bahrulolum, H., Hoseini, Z.S., Katalani, C., Hajizade, A., Easton, A.J., & Ahmadian, G. (2021). Virus-Like Particles: Preparation, Immunogenicity and Their Roles as Nanovaccines and Drug Nanocarriers. Journal of nanobiotechnology, 19(1), 59. 10.1186/s12951-021-00806-7
94. Milligan, R., Paul, M., Richardson, M., & Neuberger, A. (2018). Vaccines for Preventing Typhoid Fever. Cochrane database of systematic reviews, 5(5), Cd001261. 10.1002/14651858.CD001261.pub4
95. Clark, S.A., & Borrow, R. (2020). Herd Protection against Meningococcal Disease through Vaccination. Microorganisms, 8(11), 1675. 10.3390/microorganisms8111675
96. Daniels, C.C., Rogers, P.D., & Shelton, C.M. (2016). A Review of Pneumococcal Vaccines: Current Polysaccharide Vaccine Recommendations and Future Protein Antigens. The journal of pediatric pharmacology and therapeutics, 21(1), 27-35. 10.5863/1551-6776-21.1.27
97. Wang, S., Liang, B., Wang, W., Li, L., Feng, N., Zhao, Y., Wang, T., Yan, F., Yang, S., & Xia, Z. (2023). Viral Vectored Vaccines: Design, Development, Preventive and Therapeutic Applications in Human Diseases. Signal transduction and targeted therapy, 8(1), 149. 10.1038/s41392-023-01408-5
98. Silveira, M.M., Moreira, G.M.S.G., & Mendonça, M. (2021). DNA Vaccines Against COVID-19: Perspectives and Challenges. Life sciences, 267, 118919. 10.1016/j.lfs.2020.118919
99. Hoang, D.M., Pham, P.T., Bach, T.Q., Ngo, A.T.L., Nguyen, Q.T., Phan, T.T.K., Nguyen, G.H., Le, P.T.T., Hoang, V.T., Forsyth, N.R., Heke, M., & Nguyen, L.T. (2022). Stem Cell-Based Therapy for Human Diseases. Signal transduction and targeted therapy, 7(1), 272. 10.1038/s41392-022-01134-4
100. Cabral, J.M.S., da Silva, C.L., & Diogo, M.M. (2020). Stem Cell Bioprocessing and Manufacturing. Bioengineering (Basel), 7(3), 84. 10.3390/bioengineering7030084
101. Jin, Y., Li, S., Yu, Q., Chen, T., & Liu, D. (2020). Application of Stem Cells in Regeneration Medicine. MedComm, 4(4), e291. 10.1002/mco2.291
102. Wang, J., Sun, M., Liu, W., Li, Y., & Li, M. (2019). Stem Cell-Based Therapies for Liver Diseases: An Overview and Update. Tissue engineering and regenerative medicine, 16(2), 107-118. 10.1007/s13770-019-00178-y
103. Li, L., Ngo, H.T.T., Hwang, E., Wei, X., Liu, Y., Liu, J., & Yi, T.-H. (2019). Conditioned Medium from Human Adipose-Derived Mesenchymal Stem Cell Culture Prevents UVB-Induced Skin Aging in Human Keratinocytes and Dermal Fibroblasts. International journal of molecular sciences, 21(1), 49. 10.3390/ijms21010049
104. Rezaei, M., & Zarkesh-Esfahani, S.H. (2012). Optimization of Production of Recombinant Human Growth Hormone in Escherichia coli. Journal of research in medical sciences, 17(7), 681-685. PMC3685787
105. Gilpin, D.A., Barrow, R.E., Rutan, R.L., Broemeling, L., & Herndon, D.N. (1994). Recombinant Human Growth Hormone Accelerates Wound Healing in Children With Large Cutaneous Burns. Annals of surgery, 220(1), 19-24. 10.1097/00000658-199407000-00004
106. Rigi, G., Rostami, A., Ghomi, H., Ahmadian, G., Mirbagheri, V.S., Jeiranikhameneh, M., Vahed, M., & Rahimi, S. (2021). Optimization of Expression, Purification and Secretion of Functional Recombinant Human Growth Hormone in Escherichia coli Using Modified Staphylococcal Protein A Signal Peptide. BMC biotechnology, 21(1), 51. 10.1186/s12896-021-00701-x
107. Annerén, G., Tuvemo, T., Carlsson-Skwirut, C., Lönnerholm, T., Bang, P., Sara, V.R., & Gustafsson, J. (1999). Growth Hormone Treatment in Young Children With Down's Syndrome: Effects on Growth and Psychomotor Development. Archives of disease in childhood, 80(4), 334-338. 10.1136/adc.80.4.334
108. Frokjaer, S., & Otzen, D.E. (2015). Protein Drug Stability: A Formulation Challenge. Nature reviews drug discovery, 4(4), 298-306. 10.1038/nrd1695
109. Lipiäinen, T., Peltoniemi, M., Sarkhel, S., Yrjönen, T., Vuorela, H., Urtti, A., & Juppo, A. (2015). Formulation and Stability of Cytokine Therapeutics. Journal of pharmaceutical sciences, 104(2), 307-326. 10.1002/jps.24243
110. Murer, P., & Neri, D. (2019). Antibody-Cytokine Fusion Proteins: A Novel Class of Biopharmaceuticals for the Therapy of Cancer and of Chronic Inflammation. New biotechnology, 52, 42-53. 10.1016/j.nbt.2019.04.002
111. Arenas-Ramirez, N., Woytschak, J., & Boyman, O. (2015). Interleukin-2: Biology, Design and Application. Trends in immunology, 36(12), 763-777. 10.1016/j.it.2015.10.003
112. Wang, X., & Lin, Y. (2008). Tumor Necrosis Factor and Cancer, Buddies or Foes? Acta pharmacologica sinica, 29(11), 1275-1288. 10.1111/j.1745-7254.2008.00889.x
113. Trinchieri, G. (2003). Interleukin-12 and the Regulation of Innate Resistance and Adaptive Immunity. Nature reviews immunology, 3(2), 133-146. 10.1038/nri1001
114. Kak, G., Raza, M., & Tiwari, B.K. (2018). Interferon-Gamma (IFN-γ): Exploring Its Implications in Infectious Diseases. Biomolecular concepts, 9(1), 64-79. 10.1515/bmc-2018-0007
115. Shaldzhyan, A., Zabrodskaya, Y., Yolshin, N., Kudling, T., Lozhkov, A., Plotnikova, M., Ramsay, E., Taraskin, A., Nekrasov, P, Grudinin, M., & Vasin, A. (2021). Clean and Folded: Production of Active, High Quality Recombinant Human Interferon-λ1. Process biochemistry, 111, 32-39. 10.1016/j.procbio.2021.08.029
116. Hermant, P., & Michiels, T. (2014). Interferon-λ in the Context of Viral Infections: Production, Response and Therapeutic Implications. Journal of innate immunity, 6(5), 563-574. 10.1159/000360084
117. Ido, A., Numata, M., Kodama, M., Tsubouchi, H. (2005). Mucosal Repair and Growth Factors: Recombinant Human Hepatocyte Growth Factor as An Innovative Therapy for Inflammatory Bowel Disease. Journal of gastroenterology, 40(10), 925-931. 10.1007/s00535-005-1705-x
118. Henry, T.D., Rocha-Singh, K., Isner, J.M., Kereiakes, D.J., Giordano, F.J., Simons, M, Losordo, D.W., Hendel, R.C., Bonow, R.O., Eppler, S.M., Zioncheck, T.F., Holmgren, E.B., & McCluskey, E.R. (2001). Intracoronary Administration of Recombinant Human Vascular Endothelial Growth Factor to Patients With Coronary Artery Disease. American heart journal, 142(5), 872-880. 10.1067/mhj.2001.118471
119. Simons, M., Annex, B.H., Laham, R.J., Kleiman, N., Henry, T., Dauerman, Udelson, J.E., Gervino, E.V., Pike, M., Whitehouse, M.J., Moon, T., & Chronos, N.A. (2002). Pharmacological Treatment of Coronary Artery Disease With Recombinant Fibroblast Growth Factor-2. Circulation, 105(7), 788-793. 10.1161/hc0802.104407
120. Ivan, D.C., Berve, K.C., Walthert, S., Monaco, G., Borst, K., Bouillet, E., Ferreira, F., Lee, H., Steudler, J., Buch, T., Prinz, M., Engelhardt, B., & Locatelli, G. (2023). Insulin-Like Growth Factor-1 Receptor Controls the Function of CNS-Resident Macrophages and Their Contribution to Neuroinflammation. Acta neuropathologica communications, 11(1), 35. 10.1186/s40478-023-01535-8
121. Yamakawa S, & Hayashida K. (2019). Advances in Surgical Applications of Growth Factors for Wound Healing. Burns & trauma, 7(1), 10. 10.1186/s41038-019-0148-1
122. Park, J.W., Hwang, S.R., & Yoon, I.S. (2017). Advanced Growth Factor Delivery Systems in Wound Management and Skin Regeneration. Molecules, 22(8), 1259. 10.3390/molecules22081259
123. Ingle, R.G., & Fang, W.J. (2023). An Overview of the Stability and Delivery Challenges of Commercial Nucleic Acid Therapeutics. Pharmaceutics, 15(4), 1158. 10.3390/pharmaceutics15041158
124. Baker, D.E., & Demaris, K. (2016). Defibrotide. Hospital pharmacy, 51(10), 847-854. 10.1310/hpj5110-847
125. Chambergo-Michilot, D., Alur, A., Kulkarni, S., & Agarwala, A. Mipomersen in Familial Hypercholesterolemia: An Update on Health-Related Quality of Life and Patient-Reported Outcomes. Vascular health and risk management, 18, 73-80. 10.2147/VHRM.S191965
126. Vinores, S.A. (2006). Pegaptanib in the treatment of wet, age-related macular degeneration. International journal of nanomedicine, 1(3), 263-268. 17717967
127. Wilton-Clark, H., & Yokota, T. (2021). Casimersen for Duchenne Muscular Dystrophy. Drugs today (Barc), 57(12), 707-717. 10.1358/dot.2021.57.12.3352740
128. Robinson, C., Pham, C., Zamarripa, A.M., Dugay, C.S., Lee, C.A., Berger, A.A., Landman, A., Cornett, E.M., Kassem, H., Kaye, A.D., Urits, I., Viswanath, O., & Ganti, L. (2022). Inotersen to Treat Polyneuropathy Associated with Hereditary Transthyretin (hATTR) Amyloidosis. Health psychology research, 10(5), 67910. 10.52965/001c.67910
129. Errico, F., Marino, C., Grimaldi, M., Nuzzo, T., Bassareo, V., Valsecchi, V., Panicucci, C., Schiavi, E.D., Mazza, T., Bruno, C., D’Amico, A., Carta, M., D’Ursi, A.M., Bertini, E., Pellizzoni, L., & Usiello, A. (2022). Nusinersen Induces Disease-Severity-Specific Neurometabolic Effects in Spinal Muscular Atrophy. Biomolecules, 12(10), 1431. 10.3390/biom12101431
130. Witztum, J.L., Gaudet, D., Freedman, S.D., Alexander, V.J., Digenio, A., Williams, K.R., Yang, Q., Hughes, S.G., Geary, R.S., Arca, M., Stroes, E.S.G., Bergeron, J., Soran, H., Civeira, F., Hemphill, L., Tsimikas, S., Blom, D.J., O’Dea, L., & Bruckert, E. (2019). Volanesorsen and Triglyceride Levels in Familial Chylomicronemia Syndrome. The new England journal of medicine, 381(6), 531-542. 10.1056/NEJMoa1715944
131. Yasuda, M., & Keel, S., & Balwani, M. (2023). RNA Interference Therapy in Acute Hepatic Porphyrias. Blood, 142(19), 1589-1599. 10.1182/blood.2022018662
132. Cupido, A.J., & Kastelein, J.J.P. (2020). Inclisiran for the Treatment of Hypercholesterolaemia: Implications and Unanswered Questions from the ORION Trials. Cardiovascular research, 116(11), e136-e139. 10.1093/cvr/cvaa212
133. Scott, L.J., & Keam, S.J. (2021). Lumasiran: First Approval. Drugs, 81(2), 277-282. 10.1007/s40265-020-01463-0
134. Adams, D., Tournev, I.L., Taylor, M.S., Coelho, T., Planté-Bordeneuve, V., Berk, J.L., González-Duarte, A., Gillmore, J.D., Low, S.-C., Sekijima, Y., Obici, L., Chen, C., Badri, P., Arum, S.M., Vest, J., & Polydefkis, M. Efficacy and Safety of Vutrisiran for Patients With Hereditary Transthyretin-Mediated Amyloidosis With Polyneuropathy: A Randomized Clinical Trial. Amyloid, 30(1), 1-9. 10.1080/13506129.2022.2091985
135. Weng, Y., Li, C., Yang, T., Hu, B., Zhang, M., Guo, S., Xiao, H., Liang, X.-J., & Huang, Y. (2020). The Challenge and Prospect of mRNA Therapeutics Landscape. Biotechnology advances, 40, 107534. 10.1016/j.biotechadv.2020.107534
136. Yang, Y., Qin, Z., Zeng, W., Yang, T., Cao, Y., Mei, C., & Kuang, Y. (2016). Toxicity Assessment of Nanoparticles in Various Systems and Organs. Nanotechnology reviews, 6(3), 279-289. 10.1515/ntrev-2016-0047
137. Thi, T.T.H., Suys, E.J.A., Lee, J.S., Nguyen, D.H., Park, K.D., & Truong, N.P. Lipid-Based Nanoparticles in the Clinic and Clinical Trials: From Cancer Nanomedicine to COVID-19 Vaccines. Vaccines (Basel), 9(4), 359. 10.3390/vaccines9040359
138. Wang, J., Zhang, Y., Lu, Q., Xing, D., & Zhang, R. (2021). Exploring Carbohydrates for Therapeutics: A Review on Future Directions. Frontiers in pharmacology, 12, 756724. 10.3389/fphar.2021.756724
139. Tovar, A.M.F., Santos, G.R.C., Capillé, N.V., Piquet, A.A., Glauser, B.F., Pereira, M.S., Vilanova, E., & Mourão, P.A.S. (2016). Structural and Haemostatic Features of Pharmaceutical Heparins from Different Animal Sources: Challenges to Define Thresholds Separating Distinct Drugs. Scientific reports, 6(1), 35619. 10.1038/srep35619
140. Bae, S.H., Kim, M.R. (2020). Subtype Classification of Functional Constipation in Children: Polyethylene Glycol Versus Lactulose. Pediatrics international, 62(7), 816-819. 10.1111/ped.14235
141. Ben-Haim, S., & Ell, P. (2009). 18F-FDG PET and PET/CT in the Evaluation of Cancer Treatment Response. Journal of nuclear medicine, 50(1), 88-99. 10.2967/jnumed.108.054205
142. Bensinger, S.J., & Christofk, H.R. (2012). New Aspects of the Warburg Effect in Cancer Cell Biology. Seminars in cell & developmental biology, 23(4), 352-361. 10.1016/j.semcdb.2012.02.003
143. Lenci, E., & Trabocchi, A. (2020). Peptidomimetic Toolbox for Drug Discovery. Chemical society reviews, 49(11), 3262-3277. 10.1039/D0CS00102C
144. Mettu, R., Chen, C.-Y., & Wu, C.-Y. (2020). Synthetic Carbohydrate-Based Vaccines: Challenges and Opportunities. Journal of biomedical science, 27(1), 9. 10.1186/s12929-019-0591-0
145. Delorme, V., Lichon, L., Mahindad, H., Hunger, S., Laroui, N., Daurat, M., Godefroy, A., Coudane, J., Gary-Bobo, M., & Berghe, H.V.D. (2020). Reverse Poly(ε-caprolactone)-g-dextran Graft Copolymers. Nano-Carriers for Intracellular Uptake of Anticancer Drugs. Carbohydrate polymers, 232, 115764. 10.1016/j.carbpol.2019.115764
146. Yang, O., Qadan, M., & Ierapetritou, M. (2019). Economic Analysis of Batch and Continuous Biopharmaceutical Antibody Production: A Review. Journal of pharmaceutical innovation, 14, 1-19. 10.1007/s12247-018-09370-4
147. Van Norman, G.A. (2019). Limitations of Animal Studies for Predicting Toxicity in Clinical Trials: Is it Time to Rethink Our Current Approach? JACC: basic to translational science, 4(7), 845-854. 10.1016/j.jacbts.2019.10.008
