| Artigo Original, Biomed Biopharm Res., 2023; 20(1):3-12 doi: 10.19277/bbr.20.1.304; Versão PDF [+]; html em inglês [EN] |
Comparação das alterações de perfusão após hiperémia reactiva no membro superior avaliadas por Fluxometria de Laser Doppler e por Tomografia Fotoacústica
Sérgio Faloni de Andrade ![]() , Tiago Granja
, Tiago Granja ![]() & Luís Monteiro Rodrigues
& Luís Monteiro Rodrigues ![]()
CBIOS - Center for Biosciences & Health Technologies, Universidade Lusófona de Humanidades e Tecnologias, Campo Grande 376, 1749-024 Lisboa, Portugal
Resumo
A fluxometria de laser Doppler (LDF) é uma das tecnologias mais utilizadas para medir a perfusão sanguínea humana in vivo. No entanto, são conhecidas importantes limitações desta técnica pois a medição está limitada a um ponto único na pele numa reduzida profundidade (provavelmente inferior a 1 mm). Tecnologias mais recentes baseadas em imagem, como a Tomografia Fotoacústica (OAT), permitem a observação não invasiva de áreas de tecido mais alargadas, com maior resolução espacial. Neste estudo, comparámos dados de LDF e OAT sincronizados durante uma manobra de Hiperemia Reactiva de Pós-Oclusão (PORH) suprasistólica (artéria braquial) no membro superior. As medições foram obtidas na parte ventral do antebraço (OAT e LDF) e na ponta do dedo (LDF). Todos os procedimentos respeitaram os princípios de boas práticas clínicas para fins de investigação em humanos. Os resultados confirmam que os sinais LDF e OAT estão significativamente correlacionados no plexo superficial. O LDF não detecta estruturas vasculares mais profundas da pele mas, mesmo assim, ainda é muito útil para aceder à perfusão em áreas com maior densidade capilar, tais como acontece na ponta do dedo.
Palavras-chave: OAT, LDF, hiperemia reactiva, PORH
Como Citar: Faloni de Andrade, S., Granja, T., & Monteiro Rodrigues L. (2023) Comparative view of reactive hyperemia perfusion changes in the upper-limb by laser Doppler flowmetry and optoacoustic tomography and meta-analysis. Biomedical and Biopharmaceutical Research, 20(1), 3-12.
Correspondência a:
Recebido 10/03/2023; Aceite 14/04/2023
Introdução
A capacidade dos tecidos controlarem o seu próprio fluxo sanguíneo local proporcionalmente às suas necessidades metabólicas é um dos princípios fundamentais da função circulatória (1). Um exemplo claro desse mecanismo é observado no músculo esquelético durante o exercício físico, situação em que o fluxo sanguíneo pode exceder, dramaticamente, os valores de repouso (2,3). Uma hemodinâmica adequada depende de um processo integrado, complexo, envolvendo múltiplos sensores e efetores (4). Tal envolve uma adaptação permanente entre a macrocirculação e a microcirculação (5). A alteração desses mecanismos pode comprometer a adaptação, levando à doença (6).
O comprometimento da microcirculação parece estar na origem de condições bem conhecidas como a hipertensão, o acidente vascular cerebral, a doença arterial periférica, entre outras (7,8). No entanto, esses eventos não ocorrem de forma independente e, em última análise, afetarão todos os componentes do sistema cardiovascular (4). Isso justifica o contínuo interesse pela fisiologia cardiovascular e especificamente pela microcirculação, para encontrar marcadores melhores, mais descritivos e com relevância clínica, para permitir o diagnóstico precoce e uma melhor prevenção da doença (9,10).
O estudo da microcirculação humana in vivo deu origem a uma grande variedade de instrumentos não invasivos concebidos para descrever quantitativamente o estado vascular do indivíduo, explorando principalmente a microcirculação da pele (11,12). Algumas revisões recentes foram publicadas sobre o assunto, apontando a fluxometria laser Doppler (LDF) como uma das tecnologias mais usadas para aceder a função microcirculatória (13,14). No entanto, esta tecnologia de base óptica, apenas fornece perfusão do tecido numa área de aquisição de ponto único numa profundidade fixa, dependendo da frequência da luz do laser (15,16). Actualmente, as novas tecnologias permitem associar a quantificação de imagens a marcadores biológicos, proporcionando uma visão mais ampla da fisiologia vascular. Entre estas tecnologias contam-se a microscopia confocal e a tomografia de coerência óptica ou, mais recentemente, a tomografia optoacústica (também referida como fotoacústica) (OAT ou PAT) (17-19). No entanto, o alto custo e a complexa operação limitam sua aplicabilidade.
No presente artigo exploramos as respostas cardiovasculares obtidas in vivo após uma hiperémia reactiva supra-sistólica (PORH) aplicada na parte superior do braço, e registada por LDF e OAT. O objetivo foi identificar as principais diferenças entre as duas tecnologias de base óptica e, ao mesmo tempo, contribuir para o melhor entendimento dos mecanismos de adaptação da microcirculação envolvidos nessa manobra experimental.
Materiais e métodos
Voluntários Recrutados
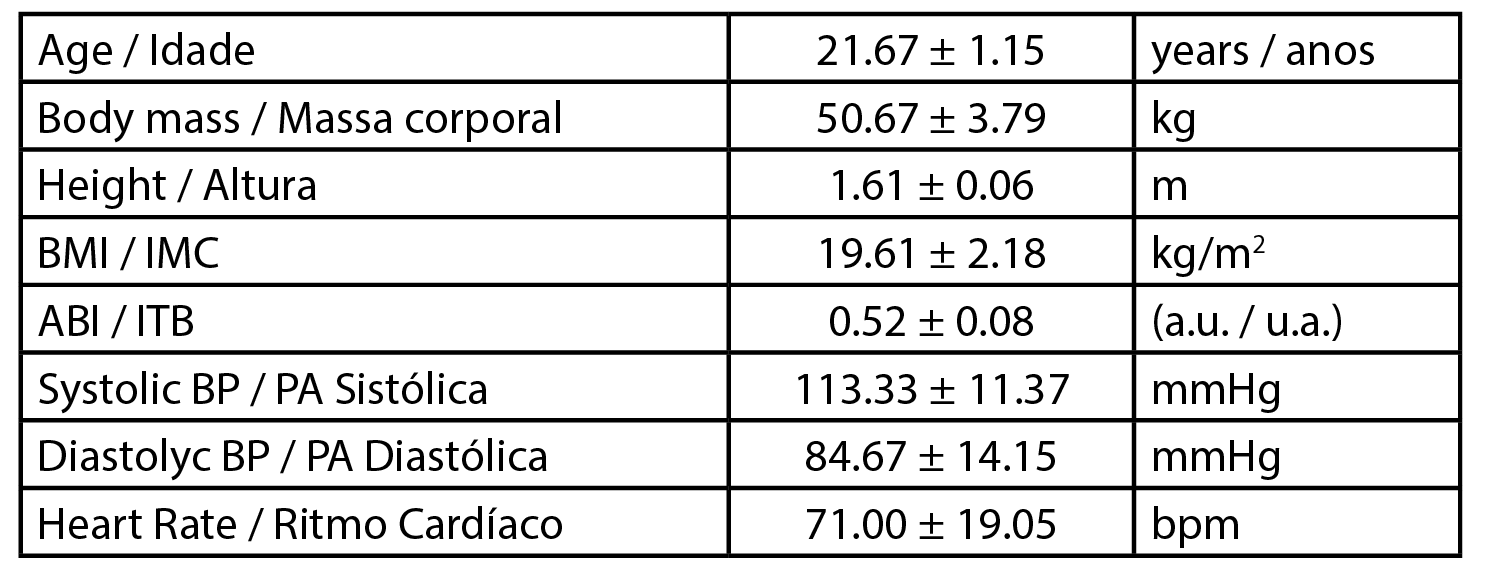
O trabalho foi desenvolvido com três participantes saudáveis do sexo feminino (n=3) com idade, massa corporal e índice de massa corporal (IMC) semelhantes. Os dados relativos à fisiologia dos participantes são apresentados na Tabela 1. Todos os procedimentos seguiram os princípios da Declaração de Helsinquia para as boas práticas clínicas e foram previamente aprovados pelo Comitê de Ética Institucional (Processo CE.ECTS/P10.21). Em suma, a seleção dos participantes obedeceu a critérios específicos de inclusão/não inclusão após consentimento informado por escrito. Os participantes eram não fumantes e não tomavam qualquer medicação ou suplementação alimentar.
| Tabela 1 - Caracterização biométrica dos voluntários. Índice de Massa Corporal (IMC), Índice Tornozelo-Braquial (ITB), Unidades Arbitrárias (u.a.); Pressão Arterial Sistólica (PA Sistólica), Pressão Arterial Diastólica (PA Diast), Ritmo Cardíaco (FC). Valores são expressos como Média ± DV. |
 |
Experimental
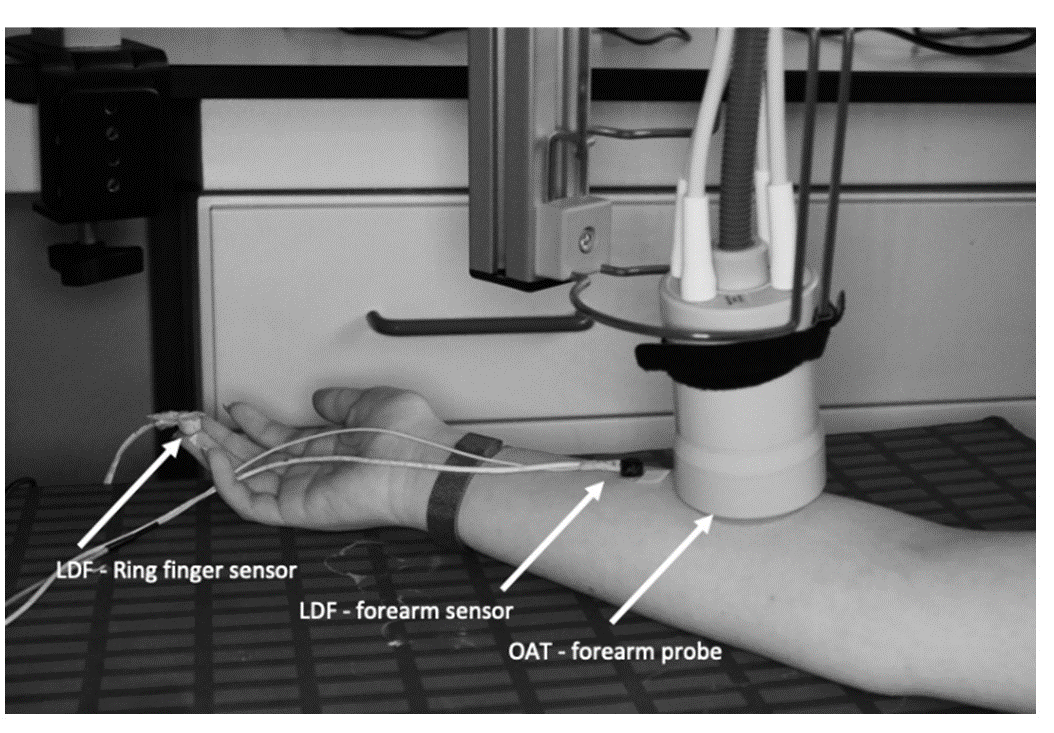
A hiperemia reactiva pós-oclusiva (PORH) foi usada como challenge. Para isso, uma manga de pressão foi aplicada na região de um dos braços dos voluntários antes da aplicação das sondas de LDF e OAT. Os participantes foram colocados em condições de repouso até estabilização da frequência cardíaca e da temperatura no ambiente laboratorial. A sonda OAT foi posicionada na região ventral do antebraço, conforme previamente descrito (15). Duas sondas LDF foram colocadas igualmente no mesmo membro - uma próxima à sonda OAT e a outra fixada na face ventral do terceiro dedo do mesmo lado (Figura 1). A manobra PORH foi registada simultaneamente em modo contínuo nas tecnologias OAT e LDF ao longo de quatro estágios diferentes, linha de base em repouso, insuflação do manguito até 200 mmHg, oclusão e recuperação. A linha de base foi registada por 1 min; a insuflação do manga até 200 mmHg foi realizada em 20 segundos; a oclusão foi mantida a 200 mmHg por 1 min e a recuperação pós-oclusão foi registada por 680 seg.
|
Figura 1 - Posição dos sensores LDF e da sonda OAT antes da manobra PORH. Um dos sensores LDF foi colocado na ponta do dedo anelar (dígito 4) do voluntário e outra na região anterior do antebraço médio. A sonda OAT foi colocada próxima ao sensor LDF do antebraço, fixada a um suporte articulado. A manobra PORH foi realizada no mesmo braço onde foram colocados os sensores LDF e a sonda OAT. |
 |
A perfusão foi registada por LDF e por OAT. O sinal de LDF (PeriFlux System 5000, Perimed AB, Järfälla, Suécia), expresso em unidades arbitrárias de perfusão (PU's), utiliza uma luz vermelha com 780 nm. A perfusão por OAT utilizou um sistema de imagem Acuity MSOT (Multispectral Optoacoustic Tomography; iThera Medical GmbH, Munique, Alemanha). O sistema OAT, produz pulsos de excitação de laser de 9 ns em comprimentos de onda de 680 nm a 980 nm, que permite adquirir os espectros cromóforos da hemoglobina oxigenada (HbO2) e da hemoglobina desoxigenada (Hb) simultaneamente, projetados como imagens 3D com profundidade de resolução de 1,5 cm3. A reconstrução dos dados OAT seguiu os protocolos do fabricante (viewMSOT 4.0) após a análise de ROI para Hb e HbO2 permitindo o cálculo de hemoglobina total (HbT) e da saturação média de O2 (MSOT SO2).
Análise de dados
Todos os gráficos foram tratados pelo GraphPad Prism 9.2.0 (283) MachineID: 0861F12DB8D10. A análise de correlação usando o teste bicaudal de Spearman foi aplicada a todas as variáveis.
Resultados e discussão
Testes exploratórios como a hiperémia reactiva pós-oclusiva supra-sistólica, foram desenvolvidos para avaliar os mecanismos adaptativos locais às alterações agudas de perfusão (17). Vários marcadores propostos para doença microvascular (MVD) estão relacionados com a resposta reactiva à perfusão, porém uma ampla variedade de condições experimentais tem prejudicado a tradução adequada dos dados, limitando a sua aplicavilidade (10,12,18). Contudo, os mecanismos envolvidos na adaptação microcirculatória à oclusão de um grande vaso permanecem amplamente desconhecidos. Resultados recentes parecem contraiar a ideia de envolverem mecanismos reflexos locais (19,20) abrindo outras direcções de investigação que requerem melhor interpretação.
No que respeita às tecnologias de avaliação, o LDF fornece informações sobre a velocidade e o volume da perfusão sanguínea numa profundidade relativamente superficial (21,22). Considerando a estrutura particular da microcirculação da pele, aceitamos que o LDF possa aceder a um número limitado de vasos (13). No entanto, o LDF tem sido amplamente utilizado como referencia para monitorar e avaliar de forma não invasiva a perfusão local (23). Tecnologias modernas como o OAT, com maior resolução espacial e temporal, fornecem informações sobre a oxigenação da hemoglobina (24-26). Tecnologias espectroscópicas e tomográficas têm sido aplicadas para estudar o impacto da PORH na microvasculatura da pele (27-30), mas persistem limitações de sincronização relacionadas com o tempo de recuperação máximo (30). Recentemente salientámos que o ajuste da HbO2 microcirculatória após a PORH envolve tanto a micro quanto a macrocirculação distribuída em diferentes profundidades teciduais (23). Essa reação só pode seguir uma resposta mediada centralmente, em vez de um reflexo local (4).
No presente estudo, exploramos o desempenho analítico do LDF e da OAT sujeitas às mesmas condições experimentais PORH (Figura 1 e Figura 2). Os sinais coletados simultaneamente com ambos os sistemas foram sincronizados após a coleta de dados de todos os participantes (Figura 3 e Figura 4).
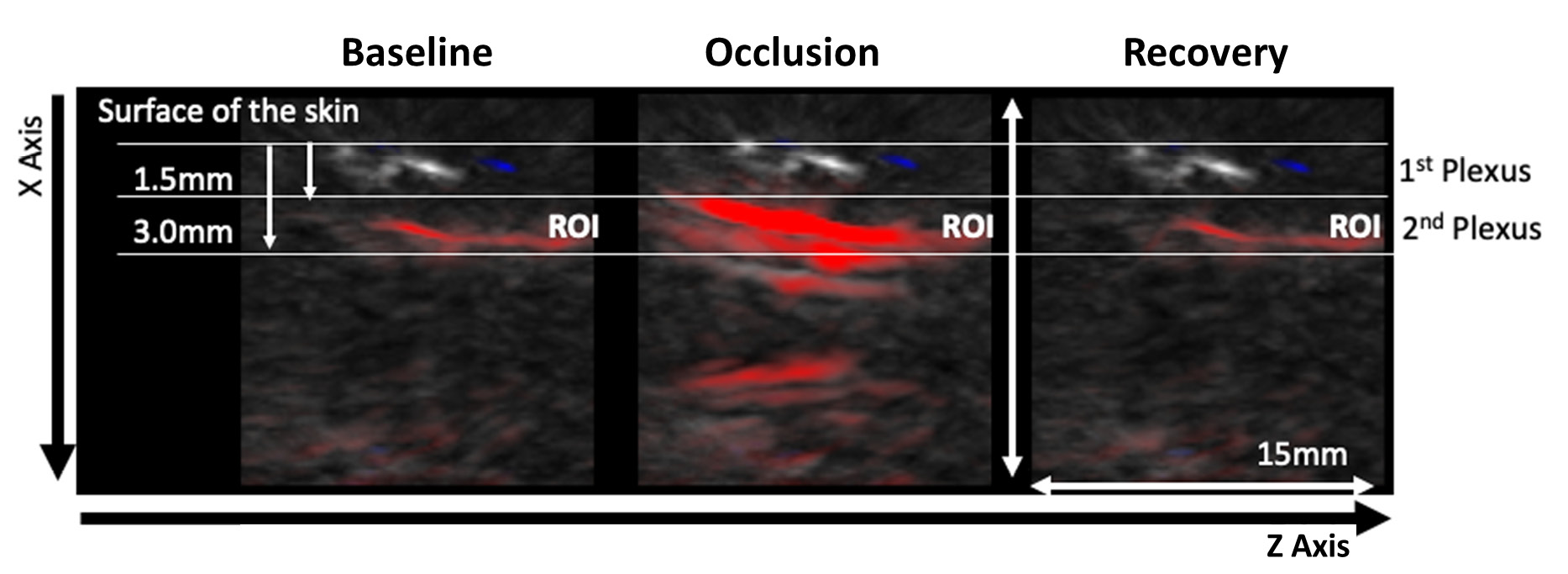
| Figura 2 - Imagens representativas obtidas através deOAT durante a manobra de PORH. A manobra PORH envolveu três fases: A) Linha de base (60 seg.); B) Oclusão a 200 mmHg (60 seg.) com manguito braquial; C) Recuperação pós-oclusiva (580 seg.). A perfusão foi registada continuamente. Vídeos da microvasculatura da pele (eixo XZ) mostram o impacto da PORH no plexo superficial (1,5 mm de profundidade) e no plexo cutâneo mais profundo (3,0 mm de profundidade). A cor vermelha representa o cromóforo HbO2. |
 |
|
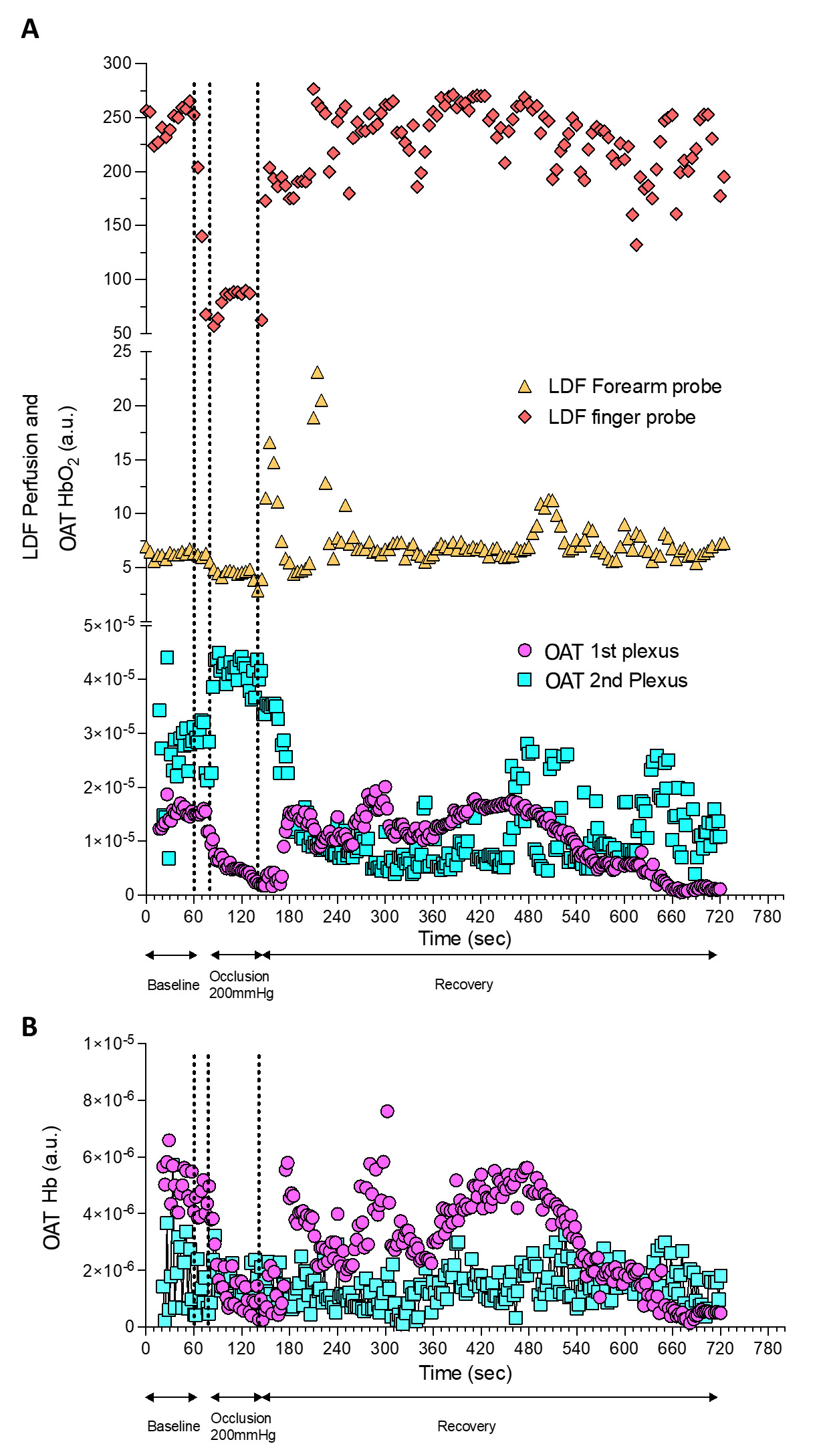
Figura 3 - Alterações de perfusão detectadas por OAT e LDF durante a manobra de PORH. Os sinais OAT e LDF adquiridos foram continuamente sincronizados durante o protocolo PORH. |
 |
| Figura 4 - HbT e mSO2 calculados pelo OAT durante uma manobra de PORH. |
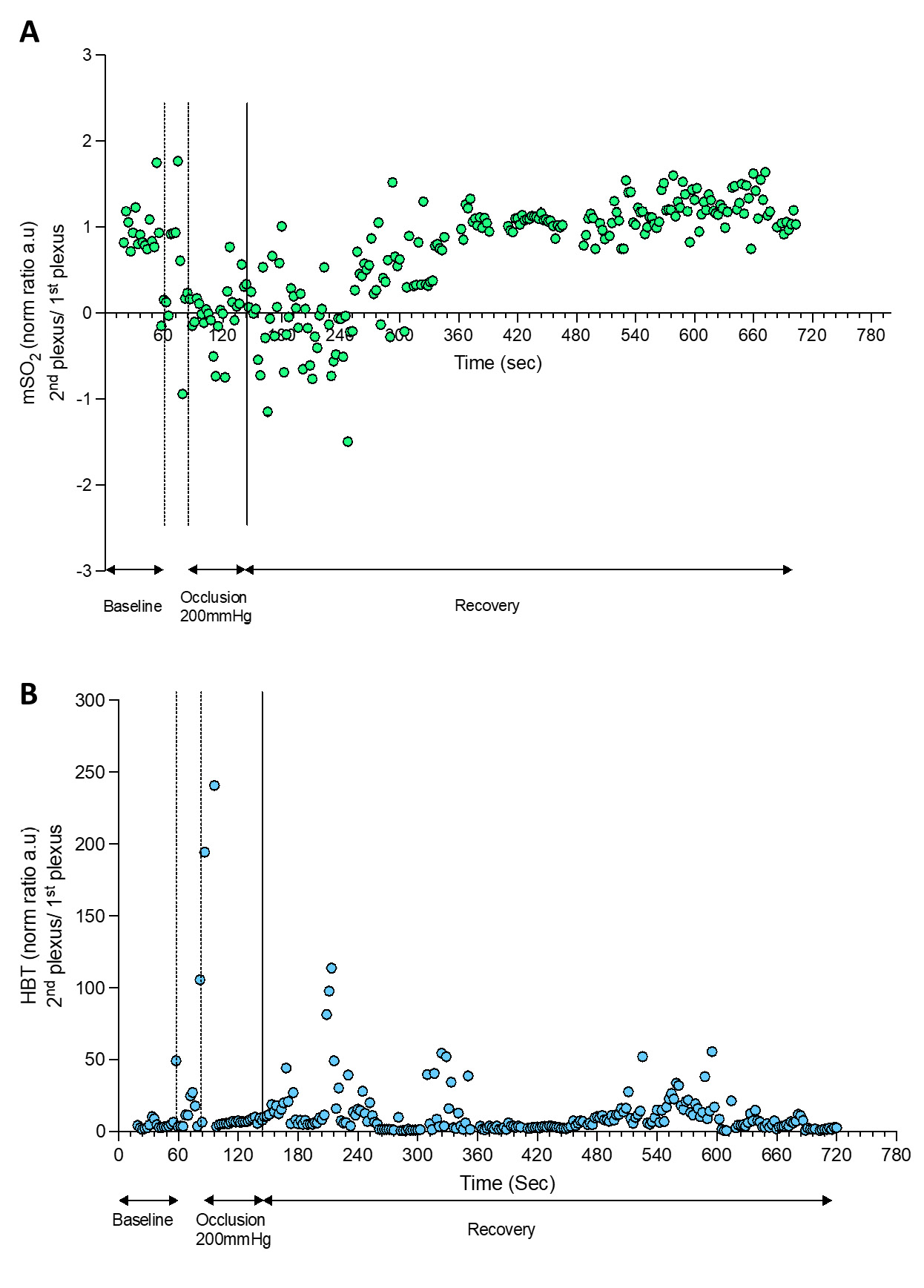 |
Nestas condições obtivémos o mesmo perfil de perfusão LDF na parte ventral do antebraço e na ponta do dedo, apesar desta última mais proeminente (Figura 3A). Tal poderá dever-se à densa rede de microcirculatória da ponta do dedo, em comparação com o antebraço, permitindo um maior efeito Doppler em medições de ponto único, em comparação com a mesma profundidade da pele na região ventral do antebraço (31-33). De facto, na pele da região ventral do antebraço, as estruturas vasculares são mais largas e o espaço entre os plexos maior, enquanto na ponta dos dedos estão muito mais próximas umas das outras (32).
O protocolo PORH envolveu uma rápida redução da perfusão tecidual com a oclusão provocada pelo manga insuflada (nunca atingindo “zero”), seguida de um rápido aumento da perfusão de HbO2 após a desinsuflação, atingindo valores basais durante a recuperação. O OAT oferece resoluções espaciais e temporais muito diferentes em comparação com o LDF num volume de 1,5 mm3 (34). Portanto, por meio do OAT conseguimos identificar tanto o plexo cutâneo superficial, quanto o plexo cutâneo mais profundo. Adicionalmente, podemos mostrar que a oclusão provoca progressivamente uma diminuição da perfusão de HbO2 no plexo superficial e um aumento da HbO2 no plexo mais profundo, explicada pela transferência sanguínea entre estes plexos descrita recentemente (23,25).
A desinsuflação do manguito permitiu a recuperação da HbO2, com retorno aos níveis basais após 580 segundos. Conforme descrito, a oclusão teve lugar no braço (artéria braquial) e as medidas foram obtidas na face volar do antebraço e na ponta do dedo. Estas respostas não são locais, mas sim mediadas por um reflexo central/medular (4).
As tecnologias LDF e OAT diferem em termos de resolução espacial, profundidade de penetração no tecido, interação entre a luz e o tecido e, conseqüentemente, na natureza das variáveis fornecidas. No entanto, nossa análise de correlação encontrou correlações positivas significativas entre os sinais LDF registados na ponta do dedo e na parte ventral do antebraço, e entre o sinal LDF da ponta do dedo e o sinal do plexo superficial no OAT.
Em conclusão, este estudo exploratório confirmou que ambas as tecnologias são úteis na medição dos efeitos locais e distais das alterações circulatórias forçadas, embora muito mais detalhes estejam disponíveis através do OAT.
Financiamento
Esta pesquisa é financiada pela ALIES e COFAC, os principais provedores da tecnologia OAT, e pela Fundação para a Ciência e a Tecnologia (FCT) através da bolsa UIDB/04567/2020 para o CBIOS.
Contribuição dos autores
Todos os autores contribuiram igualmente para o manuscrito na sua forma final.
Conflito de interesses
Os editores envolvidos na autoria desses manuscritos não tiveram participação no processo de revisão ou decisão. Todos os autores declararam que não existirem relações financeiras e/ou pessoais que possam representar um potencial conflito de interesses.
Referências
1. Hall, J. E. (2020). Guyton and Hall Textbook of Medical Physiology (14th Edition ed.).
2. Segal, S. S. (1994). Cell-to-cell communication coordinates blood flow control. Hypertension, 23(6 Pt 2), 1113-1120. doi:10.1161/01.hyp.23.6.1113
3. Trinity, J. D., Broxterman, R. M., & Richardson, R. S. (2016). Regulation of exercise blood flow: Role of free radicals. Free radical biology & medicine, 98, 90-102. doi:10.1016/j.freeradbiomed.2016.01.017
4. Rodrigues, L. M., Rocha, C., Ferreira, H. T., & Silva, H. N. (2020). Lower limb massage in humans increases local perfusion and impacts systemic hemodynamics. Journal of Applied Physiology, 128(5), 1217-1226. doi:10.1152/japplphysiol.00437.2019
5. Climie, R. E., Gallo, A., Picone, D. S., Di Lascio, N., van Sloten, T. T., Guala, A., . . . Bruno, R. M. (2019). Measuring the Interaction Between the Macro- and Micro-Vasculature. Frontiers in Cardiovascular Medicine, 6. doi:10.3389/fcvm.2019.00169
6. Lemaster, K., Jackson, D., Goldman, D., & Frisbee, J. C. (2017). Insidious incrementalism: The silent failure of the microcirculation with increasing peripheral vascular disease risk. Microcirculation, 24(2), e12332. doi:https://doi.org/10.1111/micc.12332
7. SenthilKumar, G., Gutierrez-Huerta, C. A., Freed, J. K., Beyer, A. M., Fancher, I. S., & LeBlanc, A. J. (2022). New developments in translational microcirculatory research. American journal of physiology. Heart and circulatory physiology, 323(6), H1167-H1175. doi:10.1152/ajpheart.00566.2022
8. Chade, A. R. (2011). Renovascular disease, microcirculation, and the progression of renal injury: role of angiogenesis. American journal of physiology. Regulatory, integrative and comparative physiology, 300(4), R783-790. doi:10.1152/ajpregu.00657.2010
9. Clough G., & Cracowski, J.-L. (2012). Spotlight Issue: Microcirculation—From a Clinical Perspective. Microcirculation, 19(1), 1-4. doi:https://doi.org/10.1111/j.1549-8719.2011.00142.x
10. Glazkov, A. A., Krasulina, K. A., Glazkova, P. A., Kovaleva, Y. A., Bardeeva, J. N., & Kulikov, D. A. (2023). Skin microvascular reactivity in patients with diabetic retinopathy. Microvascular Research, 147, 104501. doi:10.1016/j.mvr.2023.104501
11. Abularrage, C. J., Sidawy, A. N., Aidinian, G., Singh, N., Weiswasser, J. M., & Arora, S. (2005). Evaluation of the microcirculation in vascular disease. Journal of vascular surgery, 42(3), 574-581. doi:10.1016/j.jvs.2005.05.019
12. Virdis, A., & Taddei, S. (2011). How to evaluate microvascular organ damage in hypertension: assessment of endothelial function. High blood pressure & cardiovascular prevention : the official journal of the Italian Society of Hypertension, 18(4), 163–167. https://doi.org/10.2165/11593630-000000000-00000.
13. Humeau, A., Steenbergen, W., Nilsson, H., & Strömberg, T. (2007). Laser Doppler perfusion monitoring and imaging: novel approaches. Medical & Biological Engineering & Computing, 45(5), 421-435. doi:10.1007/s11517-007-0170-5
14. Lal, C., & Leahy, M. J. (2016). An Updated Review of Methods and Advancements in Microvascular Blood Flow Imaging. Microcirculation, 23(5), 345-363. doi:https://doi.org/10.1111/micc.12284
15. Rajan, V., Varghese, B., van Leeuwen, T. G., & Steenbergen, W. (2009). Review of methodological developments in laser Doppler flowmetry. Lasers in medical science, 24(2), 269-283. doi:10.1007/s10103-007-0524-0
16. Fagrell, B., & Nilsson, G. (1995). Advantages and Limitations of One-Point Laser Doppler Perfusion Monitoring in Clinical Practice. Vascular Medicine Review, vmr-6(2), 97-101. doi:10.1177/1358863x9500600202
17. Roustit, M., & Cracowski, J. L. (2012). Non-invasive assessment of skin microvascular function in humans: an insight into methods. Microcirculation, 19(1), 47-64. doi:10.1111/j.1549-8719.2011.00129.x
18. Yang, J., Zhang, G., Chang, W., Chi, Z., Shang, Q., Wu, M., . . . Jiang, H. (2020). Photoacoustic imaging of hemodynamic changes in forearm skeletal muscle during cuff occlusion. Biomedical optics express, 11(8), 4560–4570. https://doi.org/10.1364/BOE.392221
19. Rosenberry, R., & Nelson, M. D. (2020). Reactive hyperemia: a review of methods, mechanisms, and considerations. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 318(3), R605-R618. doi:10.1152/ajpregu.00339.2019
20. Young, G. M., Krastins, D., Chang, D., Lam, J., Quah, J., Stanton, T., . . . Askew, C. D. (2021). The Association Between Contrast-Enhanced Ultrasound and Near-Infrared Spectroscopy-Derived Measures of Calf Muscle Microvascular Responsiveness in Older Adults. Heart, Lung and Circulation, 30(11), 1726-1733. doi:https://doi.org/10.1016/j.hlc.2021.07.004
21. Bonner, R. F., & Nossal, R. (1990). Principles of Laser-Doppler Flowmetry. In A. P. Shepherd & P. Å. Öberg (Eds.), Laser-Doppler Blood Flowmetry (pp. 17-45). Boston, MA: Springer US.
22. Rajan, V., Varghese, B., van Leeuwen, T. G., & Steenbergen, W. (2009). Review of methodological developments in laser Doppler flowmetry. Lasers in Medical Science, 24(2), 269-283. doi:10.1007/s10103-007-0524-0
23. Monteiro Rodrigues, L., Granja, T. F., & de Andrade, S. F. (2022). Optoacoustic Imaging Offers New Insights into In Vivo Human Skin Vascular Physiology. Life, 12(10), 1628. Retrieved from https://www.mdpi.com/2075-1729/12/10/1628
24. Hacker, L., Brunker, J., Smith, E. S. J., Quiros-Gonzalez, I., & Bohndiek, S. E. (2020). Photoacoustics resolves species-specific differences in hemoglobin concentration and oxygenation. Journal of biomedical optics, 25(9), 095002. https://doi.org/10.1117/1.JBO.25.9.095002
25. Granja, T., Faloni de Andrade, S., & Rodrigues, L. M. (2022). Multispectral Optoacoustic Tomography for Functional Imaging in Vascular Research. Journal of visualized experiments : JoVE,(184), 10.3791/63883. doi:10.3791/63883
26. Karlas, A., Fasoula, N.-A., Katsouli, N., Kallmayer, M., Sieber, S., Schmidt, S., . . . Ntziachristos, V. (2023). Skeletal muscle optoacoustics reveals patterns of circulatory function and oxygen metabolism during exercise. Photoacoustics, 30, 100468. doi:https://doi.org/10.1016/j.pacs.2023.100468
27. Dennis, J. J., Wiggins, C. C., Smith, J. R., Isautier, J. M. J., Johnson, B. D., Joyner, M. J., & Cross, T. J. (2021). Measurement of muscle blood flow and O2 uptake via near-infrared spectroscopy using a novel occlusion protocol. Scientific Reports, 11(1), 918. doi:10.1038/s41598-020-79741-w
28. McLay, K. M., Nederveen, J. P., Pogliaghi, S., Paterson, D. H., & Murias, J. M. (2016). Repeatability of vascular responsiveness measures derived from near-infrared spectroscopy. Physiological Reports, 4(9), e12772. doi:https://doi.org/10.14814/phy2.12772
29. Yang, J., Zhang, G., Chang, W., Chi, Z., Shang, Q., Wu, M., . . . Jiang, H. (2020). Photoacoustic imaging of hemodynamic changes in forearm skeletal muscle during cuff occlusion. Biomedical Optics Express, 11(8), 4560-4570. doi:10.1364/BOE.392221
30. Didier, K. D., Hammer, S. M., Alexander, A. M., Caldwell, J. T., Sutterfield, S. L., Smith, J. R., . . . Barstow, T. J. (2020). Microvascular blood flow during vascular occlusion tests assessed by diffuse correlation spectroscopy. Experimental Physiology, 105(1), 201-210. doi:https://doi.org/10.1113/EP087866
31. Tibiriçá, E., Matheus, A. S. M., Nunes, B., Sperandei, S., & Gomes, M. B. (2011). Repeatability of the evaluation of systemic microvascular endothelial function using laser doppler perfusion monitoring: clinical and statistical implications. Clinics, 66(4), 599-605. doi:https://doi.org/10.1590/S1807-59322011000400013
32. Roustit, M., Blaise, S., Millet, C., & Cracowski, J. L. (2010). Reproducibility and methodological issues of skin post-occlusive and thermal hyperemia assessed by single-point laser Doppler flowmetry. Microvascular Research, 79(2), 102-108. doi:https://doi.org/10.1016/j.mvr.2010.01.001
33. Pouratian, N., & Toga, A. W. (2002). 5 - Optical Imaging Based on Intrinsic Signals. In A. W. Toga & J. C. Mazziotta (Eds.), Brain Mapping: The Methods (Second Edition) (pp. 97-140). San Diego: Academic Press.
34. Tiago Granja, S. F. d. A., and Luis Monteiro Rodrigues. (2021). Optoaccoustic Tomography – good news for microcirculatory research. Biomedical and Biopharmaceutical Research, 18(2), 200-212. doi: 10.19277/bbr.18.2.269
